北京义翘神州科技股份有限公司(Sino Biological Inc.)品牌商
17 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
北京义翘神州科技股份有限公司(Sino Biological Inc.)
入驻年限:17 年
- 联系人:
客服部
- 所在地区:
北京
- 业务范围:
技术服务、试剂、抗体、细胞库 / 细胞培养、ELISA 试剂盒
- 经营模式:
生产厂商
推荐产品
公司新闻/正文
登革热病毒E蛋白在抗体开发和疫苗设计中的应用前景
60 人阅读发布时间:2026-02-13 10:36
前言
登革热(Dengue fever)是全球范围内传播最广泛的蚊媒病毒性疾病之一,由登革病毒(Dengue virus, DENV)感染引起。据估计,每年约有3.9亿人感染登革病毒,约9600万人出现临床症状,目前已在全球100多个国家和地区流行。在我国,登革热流行区域逐渐扩大,约1.68亿人处于高风险区,主要在广东省。
包膜E蛋白是登革病毒表面的主要结构蛋白之一,不仅在病毒入侵宿主细胞过程中发挥核心作用,也是宿主免疫系统识别的主要抗原靶点。近年来,随着结构生物学、计算模拟与免疫学技术的快速发展,对E蛋白的结构功能解析、免疫原性特征及病理机制的理解不断深入,推动了其在疫苗研发与病毒检测技术中的创新应用。本文将综述登革病毒E蛋白的研究进展,并重点探讨其在疫苗设计、新型检测平台开发中的转化潜力,以期为生物医学研究人员提供前沿参考。
01 E蛋白的结构与功能机制
登革病毒是由RNA和蛋白质组成的二十面立体对称的病毒颗粒,壳蛋白(C)、膜蛋白(M)和包膜蛋白(E)构成其结构形状。病毒表面共有180个E蛋白分子,两两联合形成90个首尾相连的同源二聚体,每3个二聚体形成一个包含两个不对称的筏状结构,最终这30个筏状结构以二十面体对称的方式排列,构成病毒的完整外壳。
登革病毒有4个遗传相似但表面抗体不同的血清型:DENV-1、DENV-2、DENV-3和DENV-4,均可感染人类。人体在感染后会对同型病毒产生免疫力,但对异型病毒无保护力,甚至再次感染异型病毒后能引起更严重的症状,即抗体依赖性增强效应(ADE)。
不同血清型的E蛋白基因序列会因毒株不同而略有差异。如DENV-1型的US/Hawaii/1944毒株,DENV-2型的New Guinea C/Puo-218 hybrid毒株,DENV-3型的Philippines/H87/1956,DENV-4型的Philippines/H241/1956毒株,E蛋白对应的核苷酸片段和序列长度存在一定程度的区别。
E蛋白包含3个结构域:DⅠ、DⅡ、DⅢ。DⅠ尽管位于E蛋白的N端,但在三维空间结构中处于分子中央位置,连接DⅡI和DⅢ,参与pH依赖的构象重排,含有血清型特异的非中和表位。DⅡ富含疏水性融合肽,在酸性环境中暴露,介导病毒与宿主细胞的膜融合。DⅢ具有免疫球蛋白样折叠。含有强中和活性表位及交叉反应性抗原表位,介导病毒感染,是中和抗体和疫苗开发的重要靶点。
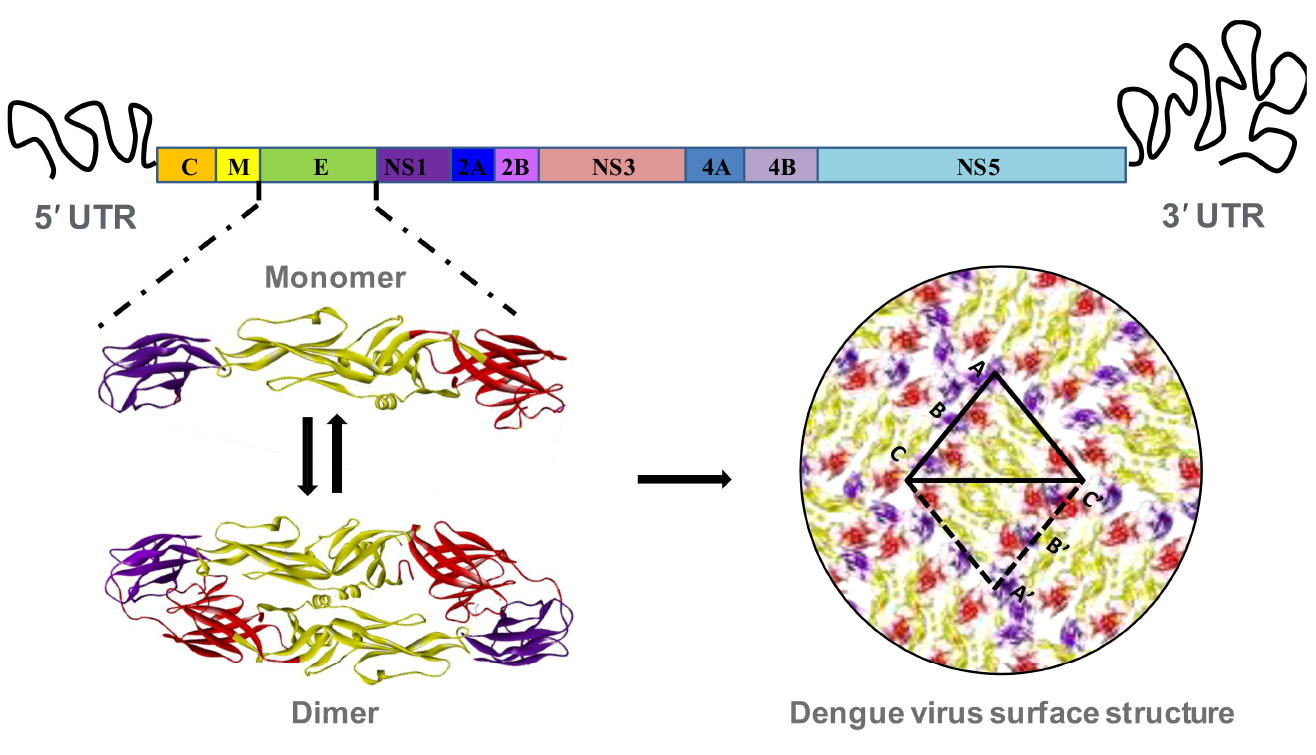
登革病毒E蛋白结构示意图,结构域Ⅰ、Ⅱ、Ⅲ分别用红色、金色和紫色表示(源自参考文献:doi: 10.3389/fimmu.2023.1200195)
E蛋白为Ⅰ型跨膜糖蛋白,在病毒表面以同源二聚体的形式存在。每个E蛋白亚基含有两个N-糖基化位点:Asn-67和Asn-153。Asn-153在大多数黄病毒中保守,而Asn-67是登革病毒特有的糖基化位点。糖基化位点在病毒附着和入侵过程中发挥重要作用。
E蛋白在病毒生命周期中具有多重功能。首先,DⅢ结构域与细胞表面受体结合,介导病毒的初始吸附。其次,E蛋白在酸性内体环境中发生构象变化,二聚体解离,形成三聚体刺突结构,驱动病毒进入细胞,释放RNA基因组,启动感染过程。此外,E蛋白还参与病毒的装配、成熟和释放。同时,E蛋白作为主要抗原,诱导机体产生中和抗体和T细胞应答。
02 E蛋白在单克隆抗体开发中的应用
单克隆抗体在登革热治疗中具有独特优势。从抗体靶向表位来区分,主要分为三类:靶向血清型特异性表位抗体、靶向交叉反应性表位的抗体和靶向四级空间表位的抗体。
靶向血清型特异性表位抗体具有强效中和活性,能对同型病毒提供持久免疫力。DENV1是病毒4种血清型中最主要的致病类型,因此是抗体研究的优先对象。如E1和E2抗体具有中和活性,且与其他血清型无交叉反应,与DENV1 E蛋白DⅢ结构域的Thr346和Asp360之间的独特表位结合。1A1D-2是针对DENV-2的强效中和抗体,与其高度保守的Glu383和Pro384位点有关。单抗5H2的结合位点位于DENV-4的结构域Ⅰ。
交叉反应性抗体特异性靶向结构域Ⅱ的融合环与bc环。如人源B3B9能强效中和所有登革病毒血清型,但在表达Fcγ受体的细胞中表现出病毒增强活性。2A10G6抗体结合结构域 Ⅱ上的98DRXW101保守基序,有效中和DENV所有血清型,在病毒吸附阶段发挥抗感染作用。SIgN-3C及其LALA突变体在所有DENV血清中保护效果抑制。D448抗体可与五个关键残基发生相互作用。这些残基位于包膜蛋白的膜区与胞外域之间的隐蔽连接区域,D448可能会干扰膜与包膜的相互作用。鼠源抗体9F12,不仅可与所有登革病毒血清型发生交叉反应,还能与西尼罗病毒交叉反应。
还有一类新型的高中活性抗体,特异性识别病毒表面的特定结构元件。5J7可识别E蛋白二聚体分子间连接区域的隐蔽四级结构,抑制膜融合。1F4抗体对结构域Ⅰ与Ⅱ的铰链区夹角高度敏感,仅能与病毒颗粒结合,无法结合游离的包膜蛋白。此外,研究人员还发现多种人源单抗,可结合DENV的反平行二聚体表位或识别病毒表面高度有序的四级结构,如2D22与8个相邻的氨基酸残基发生作用。
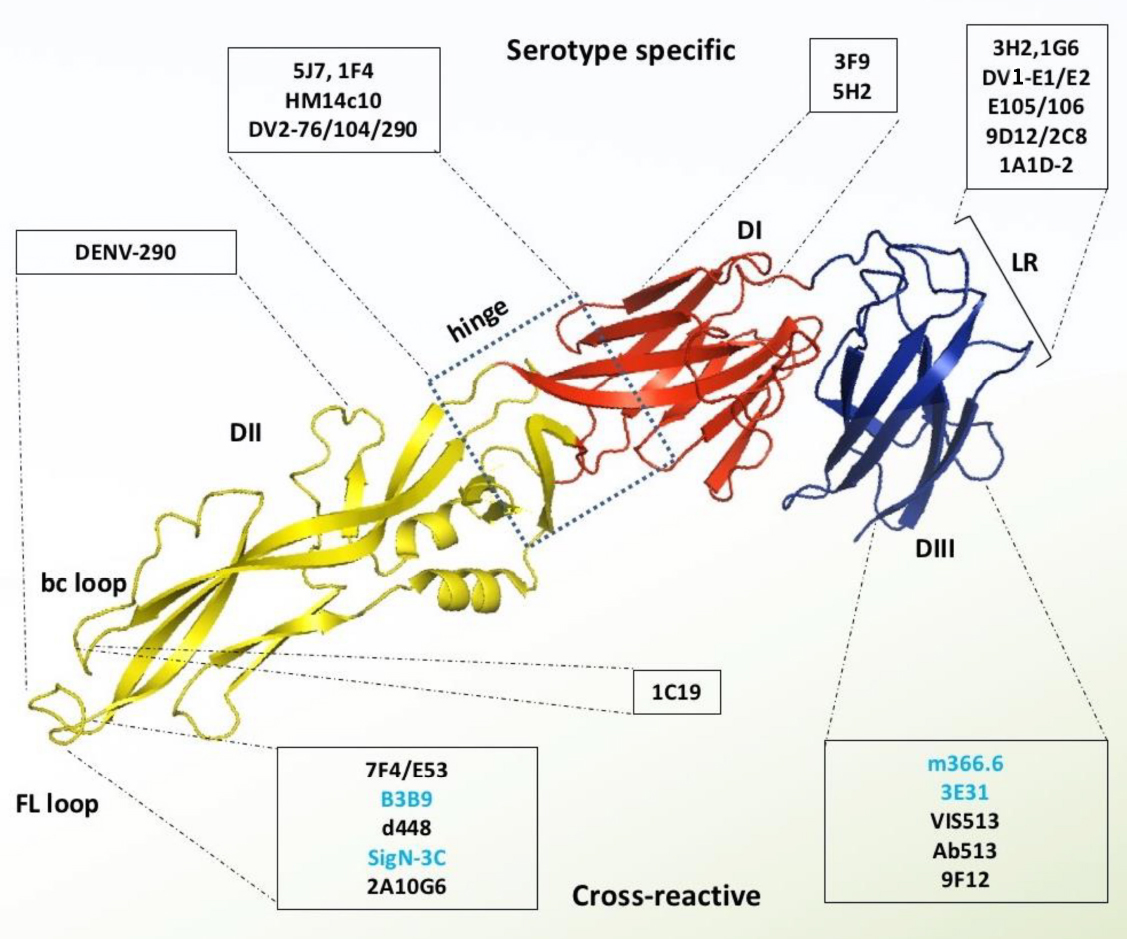
靶向E蛋白的单克隆抗体(源自文献:doi: 10.3389/fimmu.2023.1200195)
03 E蛋白在疫苗设计中的进展
减毒活登革热疫苗先行。
全球第一个上市的疫苗Dengvaxia(CYD-TDV)由法国赛诺菲巴斯德公司研制,基于黄热17D病毒株骨架,将编码prM蛋白和E蛋白的基因替换为野型登革病毒相应区域的基因。目前,墨西哥、菲律宾和美国等国先后批准了该疫苗,用于年龄9-45岁、有登革病毒既往感染史的人群。
Qdenga(TAK-003)疫苗是第二个获批上市的登革四价减毒活疫苗,由日本武田制药公司生产,于2020年12月获得欧盟委员会批准,并在印度尼西亚、巴西、阿根廷、英国和德国等国家获得许可。TAK-003以DENV2病毒株TDV-2作为病毒骨架,通过将编码prM蛋白和E蛋白的基因替换为野型登革病毒相应区域的基因获得其余三个血清型的疫苗株。
TV003(Butantan-DV)四价减毒活疫苗来自美国国立卫生研究院,正处于3期临床试验阶段,含3种基因减毒株(DENV-1/3/4的3'UTR缺失)和1种嵌合株(DENV-4 prM/E替换为DENV-2)。巴西Butantan-DV单剂疫苗三期试验显示,对无感染史人群保护率为80%,有感染史人群达89%。
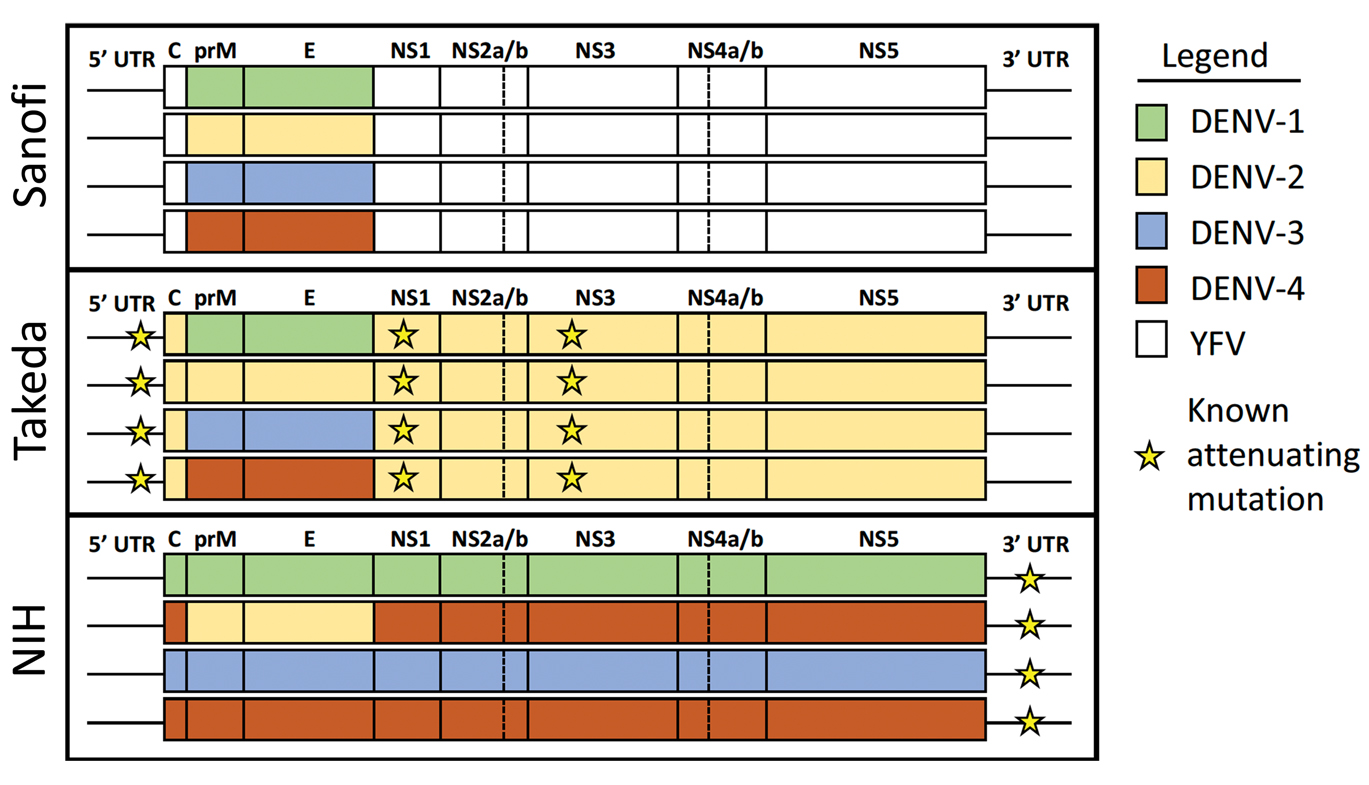
3种减毒活疫苗的设计策略(源自文献:doi: 10.1038/s41541-023-00658-2)
面对传统登革热疫苗研发受困于ADE、血清型免疫应答不均衡等问题,研究人员正在基于E蛋白开发新的疫苗设计策略。病毒样颗粒(VLP)、嵌合疫苗、mRNA疫苗研究不断取得新进展。
2025年5月,Vaccine发表一篇题为“Enhanced immunogenicity of an mRNA vaccine against dengue virus serotype 2 with modified key residue”的研究文章,台北的研究人员通过设计E蛋白抗原表位(DENV2亚型来源的E N8R突变体),制备了一款mRNA-LNP疫苗。实验结构表明该疫苗诱导的抗体滴度高于野生型E蛋白,且ADE效应显著降低。小鼠体内实验发现,相较于传统DNA疫苗,mRNA-LNP诱导的抗体滴度提升约10倍,适合快速应对病毒变异。
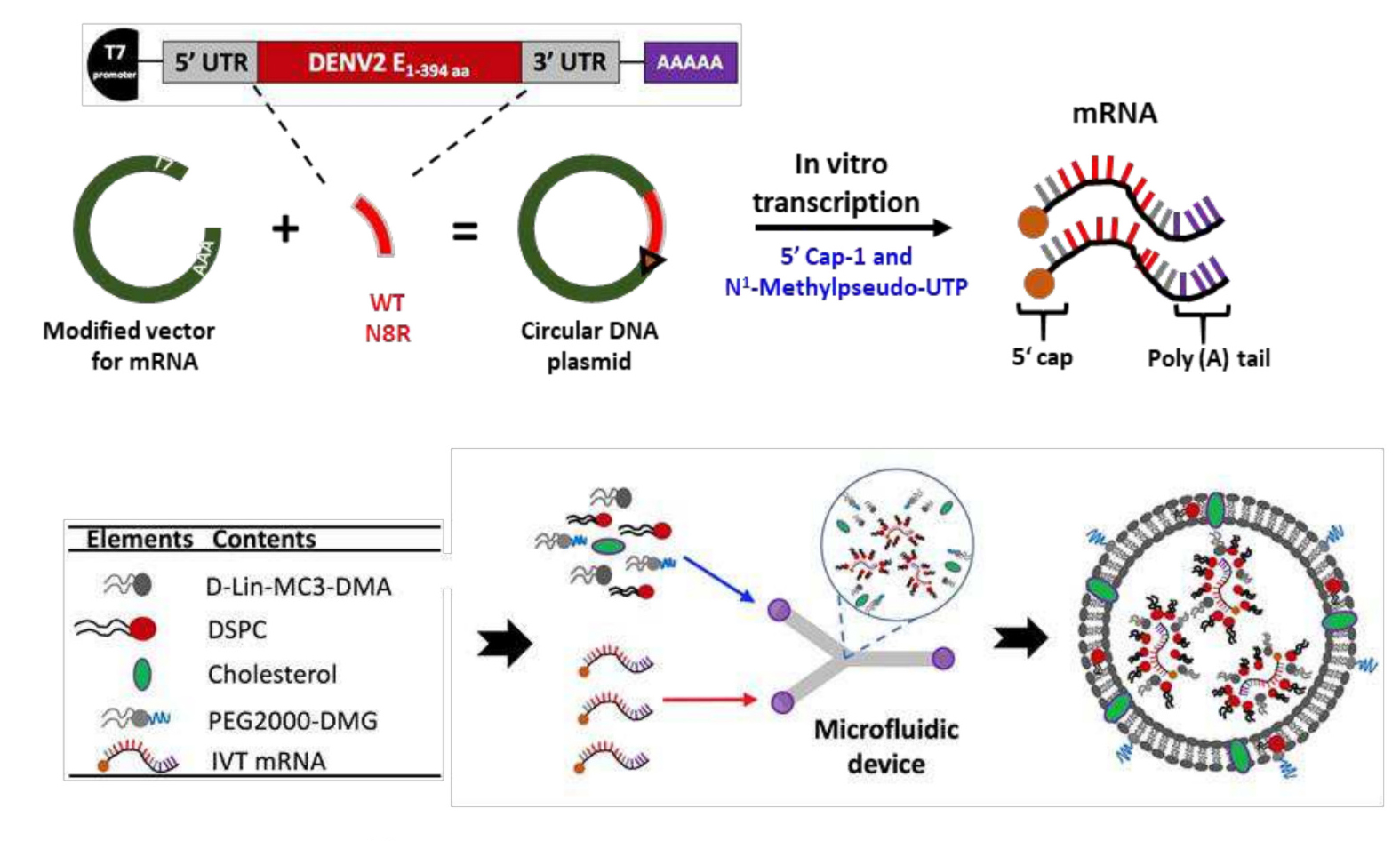
mRNA-LNP疫苗的设计理念及其制备示意图(源自文献:doi: 10.1016/j.vaccine.2025.127216)
04 结语
登革病毒E蛋白是连接病毒基础研究与临床转化的关键蛋白,其研究已经从结构解析走向抗体筛选、疫苗开发等领域。随着E蛋白研究的不断深入,必将会为全球登革热防控提供强有力的科技支持。
义翘神州已成功开发4种血清型不同毒株的E重组蛋白,种类全,纯度高,应用广,助力DENV抗体发现和疫苗开发。
【参考文献】
1. Sarker A, Dhama N and Gupta RD. Dengue virus neutralizing antibody: a review of targets, cross-reactivity, and antibody-dependent enhancement. Front. Immunol. 2023. doi: 10.3389/fimmu.2023.1200195
2. Stephen J. Thomas. Is new dengue vaccine efficacy data a relief or cause for concern? npj Vaccines 2023;
3. Monika Kumari, et al. Enhanced immunogenicity of an mRNA vaccine against dengue virus serotype 2 with modified key residue. Vaccine, 2025.