北京义翘神州科技股份有限公司(Sino Biological Inc.)品牌商
17 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
北京义翘神州科技股份有限公司(Sino Biological Inc.)
入驻年限:17 年
- 联系人:
客服部
- 所在地区:
北京
- 业务范围:
技术服务、试剂、抗体、细胞库 / 细胞培养、ELISA 试剂盒
- 经营模式:
生产厂商
推荐产品
公司新闻/正文
综述CAR-T治疗实体瘤挑战,探索新兴靶点破局之路
479 人阅读发布时间:2025-08-15 09:19
前言
CAR-T细胞疗法靶点集中度较高。在血液肿瘤方面,目前国内外研究最多的靶点依然是CD19,其次是BCMA、CD22,除此之外还有CD20、PD-1、CD33等。而实体瘤方面,国内外靶点布局存在差异,比如国内大热的Claudin-18.2在国外鲜有研究,类似的靶点还有CEACAM5、HPK1。在国外布局较多的ROR1、FRα管线在国内较少。
义翘神州提供多种类型靶点蛋白,具有高纯度、高活性等特性,助力CAR-T细胞开发。通过VLP、Nanodisc、Detergent三大跨膜蛋白技术平台,自主开发了GPRC5D、Claudin 18.2、SSTR2等多次跨膜靶点蛋白。还提供多种标记类型的靶点蛋白,灵活满足CAR-T不同研发需求。
1.CAR-T治疗实体瘤的挑战
近期,Cancer Cell期刊发表一篇题为“CAR-T therapy in solid tumors”的综述文章,对CAR-T在实体瘤领域的临床进展和挑战进行了探讨,并对突破实体瘤治疗瓶颈的策略进行总结。
创新性的CAR-T疗法在少数实体瘤患者中展现出治疗潜力。部分临床试验显示,EGFR CAR-T在非小细胞肺癌的中位无进展生存期(PFS)为7.13个月,总生存期(OS)达到15.63个月。GPC3CAR-T在肺癌中显示出90.9%的疾病控制率(DCR)和50%的客观缓解率(ORR)。CLDN18.2CAR-T在胃癌中显示出91.8%疾病控制率(DCR)。双靶点EGFR/IL13Ra2 CAR-T细胞使6例复发性胶质母细胞瘤患者肿瘤体积减少。
但是CAR-T在实体瘤治疗中面临四大挑战,亟待突破:
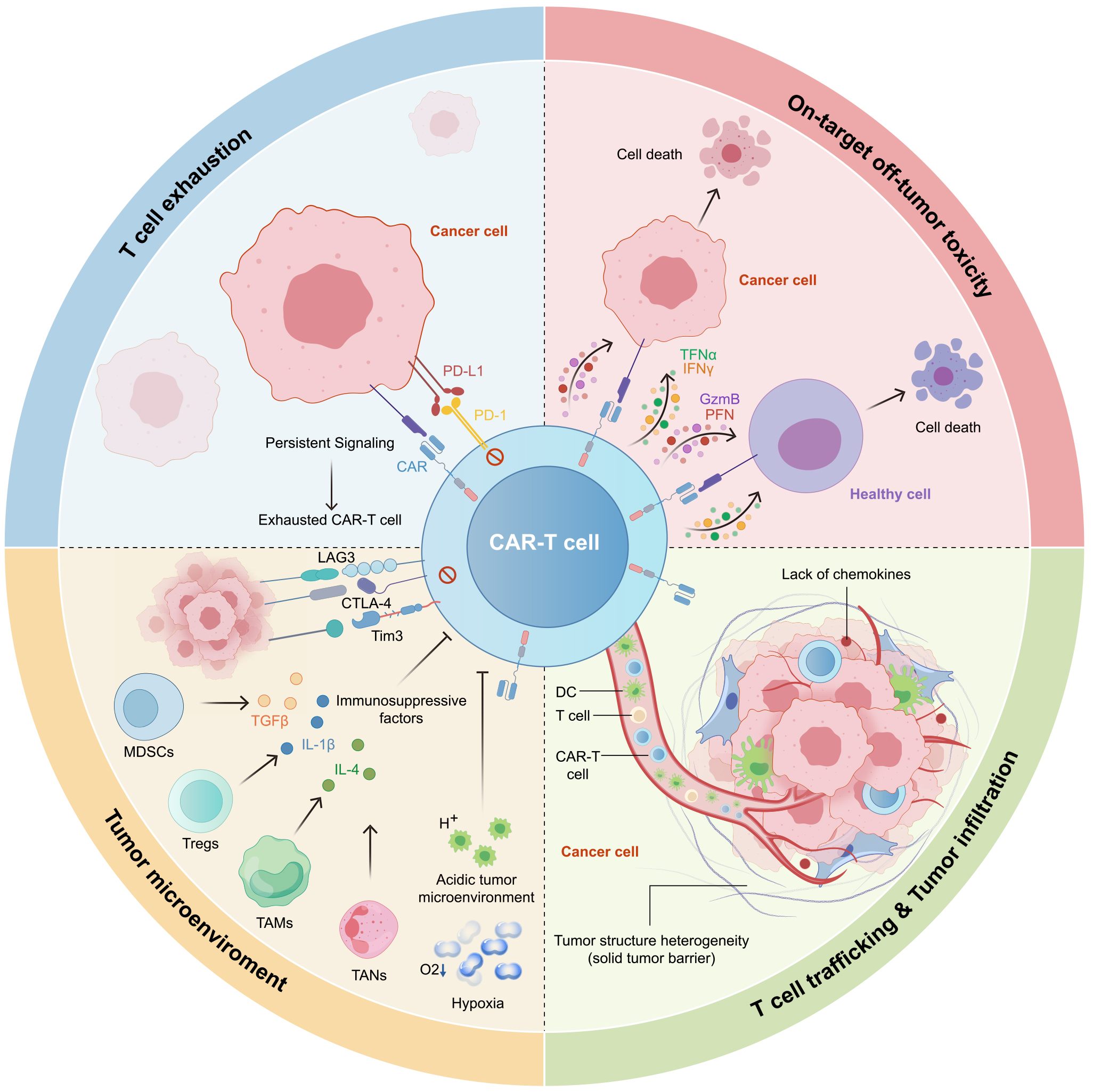
CAR-T细胞疗法在实体瘤中的困境(源自文献:doi: 10.1016/j.ccell.2025.03.019)
(一)T细胞耗竭:疗效维持下降
CAR-T细胞在实体瘤患者体内容易出现增殖力不足、存活时间短等难题,主要是与肿瘤微环境的抑制作用及T细胞过度活化有关,表现为效应因子分泌减少,如穿孔素、颗粒酶B,免疫检查点表达升高,最终导致失去抗肿瘤作用。
(二)误伤正常细胞:精准治疗的双刃剑
部分肿瘤靶点也会在正常组织中表达,引起“On-target off tumor”毒性。比如靶向Claudin18.2的CAR-T细胞可能攻击胃黏膜上皮细胞,导致严重的胃肠道毒性。靶向EGFR的CAR-T细胞可能损伤肺上皮细胞,引发间质性肺炎。
(三)T细胞难迁移浸润:精准靶向“拦路虎”
实体瘤中,基质结构紧密,具有纤维组织的物理屏障,趋化因子表达匮乏,会造成CAR-T细胞的定位和浸润障碍。且肿瘤内不同区域、细胞亚群的抗原表达水平差异大,抗原异质性也会导致CAR-T细胞无法完全覆盖全部肿瘤细胞,不被识别的细胞会成为肿瘤复发的根源。
(四)肿瘤微环境:T细胞“升级打怪”的必经之路
实体瘤微环境属于高度免疫抑制系统,巨噬细胞、Tregs细胞通过分泌TGF-β、IL-10等抑制性细胞因子,削弱CAR-T效力。实体瘤的缺氧环境、酸性pH值同样会抑制T细胞功能,同时诱导表达PD-1、LAG3等免疫检查点分子,导致T细胞耗竭。
2.探索CAR-T新兴靶点
为解决CAR-T面临的这些挑战,科研人员一直在不懈的探索和创新,希望在提高CAR活性持续时间的同时降低其耗竭和毒性。通过免疫检查点抑制、靶向抗原选择、基因编辑、双靶点、联合疗法等多种策略进行细化,增强CAR-T的抗肿瘤效果。
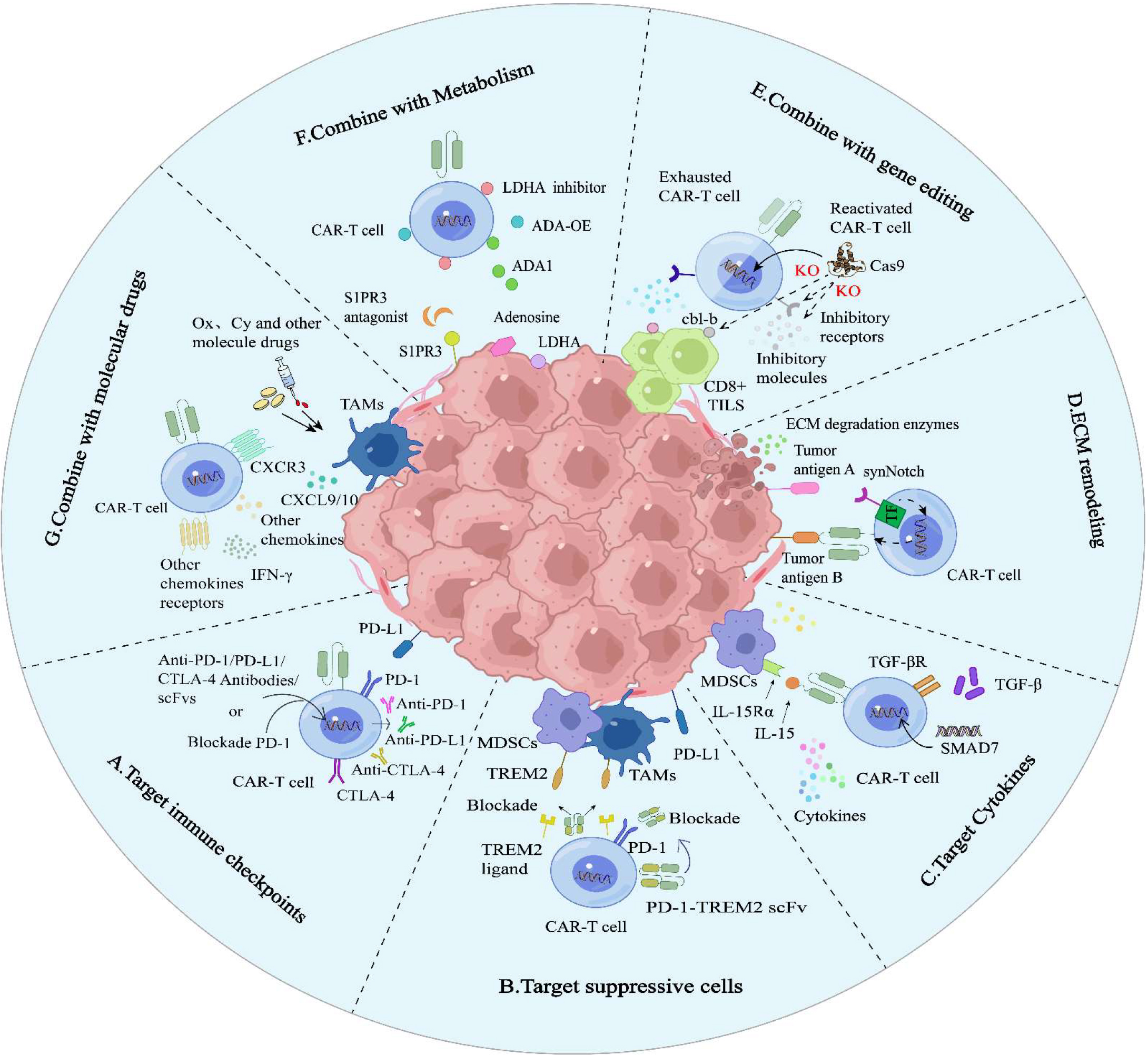
CAR-T细胞疗法在实体瘤领域的新突破(源自文献:doi: 10.70322/immune.2025.10006)
A. 联合免疫检查点抑制剂
PD-1持续表达会抑制CAR-T细胞的活化和增殖,研究发现阻断PD-1信号转导可以有效增强CAR-T细胞的持久性以及减少T细胞耗竭。比如使用PD-1抗体、shRNA阻断免疫检查点或引入PD-1显性负受体,破坏PD-1/PD-L1通路,成功恢复CD28 CAR-T细胞的效应功能。设计分泌PD-1阻断scFvs的CAR-T,能够显著增强CAR-T细胞自身和肿瘤特异性T细胞的抗肿瘤活性。
有研究发现将CAR-T细胞治疗与局部CD47阻断相结合,可在体外和肿瘤微环境中逆转骨髓单核细胞的免疫抑制。CD47是一种先天免疫检查点跨膜糖蛋白,广泛表达于多种癌细胞表面,通过与巨噬细胞表面的信号调节蛋白SIRP结合,协助肿瘤细胞逃逸,还可与血小板反应蛋白TSP-1结合,抑制信号转导并促进肿瘤细胞增殖。EGFRvIII-SGRP CAR-T细胞能够分泌CD47阻断剂SGRP,既靶向EGFRvIII阳性细胞,又解除CD47介导的免疫抑制。
B. 靶向免疫抑制细胞
髓系来源的免疫抑制细胞MDSCs抑制T细胞活性,降低细胞毒性T细胞对肿瘤细胞的杀伤作用,同时还分泌免疫抑制因子,进一步削弱免疫系统的功能,具有促进肿瘤生长、转移和免疫逃逸的功能。研究发现阻断CXCR2,阻止MDSC向肿瘤迁移能显著提高CAR-T细胞的浸润和治疗效果。在一种针对结直肠癌(CRC)相关抗原CEA CAR-T细胞中,含有自分泌PD-1-TREM2 scFv,能够阻断PD-1/PD-L1通路,并调节MDSC和肿瘤相关巨噬细胞(TAM),在小鼠模型中表现出显著的肿瘤根除能力,并超过仅分泌PD-1的CAR-T细胞疗效。
C. 靶向细胞因子
CAR-T细胞的细胞因子工程改造是克服实体瘤局限性的有希望策略之一。将膜结合IL-12分子导入CAR-T细胞,在体外表现出增强的抗原依赖性增殖,且在人卵巢异种移植模型中具有强大的体内功效。同时表达IL-15的GPC3 CAR-T细胞增殖显著提升。共表达膜结合IL-15的CAR-T在有效性、浸润、肿瘤抑制等方面都有增强,还能激活NK细胞和减少M2巨噬细胞。
IL-18能增强T细胞和NK细胞的激活,促进INF-γ的产生,进而改善肿瘤的免疫微环境。“装甲型”CAR-T经过经过基因工程改造,增强其额外功能。比如在小鼠模型中,IL-18装甲型CAR-T细胞具有良好的抗肿瘤效果。GD2IL-18 CAR-T是德国科研人员开发的一种靶向GD2的CAR-T细胞产品,通过诱导性分泌IL-18增强抗肿瘤效应,能够根除GD2阳性的肿瘤异种移植物。
抑制TGF-β通路能够同时缓解T细胞衰竭和抑制细胞因子的过度释放,因此成为优化CAR-T细胞治疗的潜在靶点。共表达SMAD7的CAR-T细胞能有效抑制TGF-β通路,提高CAR-T治疗实体瘤的效果。靶向IL-13Rα2和TGF-β的双特异性CAR-T细胞提高胶质瘤模型小鼠的生存率。
EGFR在肿瘤细胞中过表达,与肿瘤的侵袭和转移密切相关。特异性靶向EGFRvIII的第二代CAR-T在胶质瘤患者中具有较高的抗肿瘤效果。双靶点CAR-T细胞(EGFR和IL-13Rα1)可使胶质母细胞瘤类器官中的肿瘤细胞减少和溶解。EGFR-SMAD7 CAR-T在第20天导致肿瘤完全消除。研究人员还开发出一种在酸性环境中对实体瘤高效的EGFRvIII CAR-T细胞。
D. ECM重塑
肿瘤细胞外基质(ECM)是阻碍CAR-T细胞渗透和移动的主要原因之一。比如科研人员利用synNotch技术构建CAR-T细胞,能够在肿瘤微环境中特异性识别并分泌ECM降解酶。从而增加CAR-T细胞的渗透能力,并清除实体瘤。
E. 基因编辑
中山大学的研究团队构建了PTG-T16R-scFV-CAR-T细胞,通过敲低PD-1、Tim-3、Tigit、TGF-βR、IL-10R、IL-6R这六种抑制因子,增强了CAR-T细胞抗胆管癌活性。在实体瘤异种移植模型中,敲低人CAR-T细胞中的Nrf2已被证明可提高瘤内CAR-T细胞的存活和功能,有效控制肿瘤生长。
总之,CAR-T作为一种创新性细胞疗法,在实体瘤治疗中受到复杂的肿瘤微环境影响。通过多种策略对CAR-T进行工程改造,如免疫检查点抑制、细胞因子共表达、靶向特定抗原等,有望逆转T细胞衰竭,提高抗肿瘤能力。
义翘神州CAR-T相关靶点蛋白
义翘神州提供多种类型靶点蛋白,具有高纯度、高活性等特性,助力CAR-T细胞开发。通过VLP、Nanodisc、Detergent三大跨膜蛋白技术平台,自主开发了GPRC5D、Claudin 18.2、SSTR2等多次跨膜靶点蛋白。还提供多种标记类型的靶点蛋白,灵活满足CAR-T不同研发需求。
【参考文献】
1.Bing Du, et al. CAR-T therapy in solid tumors. Cancer Cell. 2025.
2.Yitong Li, et al. Advances in CAR-T Cell Therapy for Solid Tumors. Immune Discovery 2025