北京义翘神州科技股份有限公司(Sino Biological Inc.)品牌商
16 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
北京义翘神州科技股份有限公司(Sino Biological Inc.)
入驻年限:16 年
- 联系人:
客服部
- 所在地区:
北京
- 业务范围:
技术服务、试剂、抗体、细胞库 / 细胞培养、ELISA 试剂盒
- 经营模式:
生产厂商
推荐产品

Complement component 3重组蛋白|Recombinant Mouse Complement component 3 Protein (His Tag)
品牌:Sino Biological
¥4520 - 29350
咨询公司新闻/正文
「综述文章」CAR-T突破实体瘤微环境抑制的5大策略及靶点研究新进展
5765 人阅读发布时间:2025-09-25 08:55
2025年CAR-T在实体瘤治疗领域取得“革命性突破”,多项研究显示其在胃癌、肠癌、肝癌等实现长期缓解,通用型CAR-T、体内CAR-T等技术有实质性进展,从实验室研究进入临床早期试验。
CAR-T治疗实体瘤的关键是靶点选择,目前常用的靶点有HER2、EGFR、GPC3、Claudin18.2等。科研人员也在积极探索其他靶点的应用潜力,如MSLN、GD2、CEA、DLL3、BCMA等。
CAR-T治疗实体瘤的挑战与对策
2025年4月份,华东师范大学的刘明耀、杜冰教授团队在Cancer Cell(IF 44.5)发表题为“CAR-T therapy in solid tumors”的综述文章,系统探讨了CAR-T细胞疗法在实体瘤中面临的挑战,并对突破瓶颈的策略进行全面总结。
作者认为CAR-T细胞治疗实体瘤有4大瓶颈亟待突破:
1. T细胞耗竭:疗效维持下降
2. 误伤正常细胞:精准治疗的双刃剑
3. T细胞难迁移浸润:精准靶向“拦路虎”
4. 肿瘤微环境:T细胞“升级打怪”的必经之路
如果您对这四大挑战的细节感兴趣,可以查看“综述CAR-T治疗实体瘤挑战,探索新兴靶点破局之路”,本文不再赘述。
作者还对优化提升CAR-T细胞治疗实体瘤的相关研究进展进行归纳总结,提出5个升级方案:
1 优化CAR结构
双靶点CAR是克服抗原异质性的有效策略。研究发现GD2/B7-H3双靶点CAR-T细胞在神经细胞瘤模型中的杀伤能力比单靶点更强。采用“AND”逻辑门控CAR-T,即只有两种抗原同时存在时才能激活CAR-T细胞,有望降低脱靶效应,如针对HER2和IL-13Rα2的CAR-T细胞在胶质母细胞瘤中实现特异性杀伤。
肿瘤微环境常为酸性(pH 6.0-6.5),因此开发pH敏感型CAR-T能够实现肿瘤特异性识别。在小鼠模型中,pH敏感型CAR-T细胞可有效区分HER2低表达的正常组织和高表达的肿瘤组织。
开发新型CAR:STAR-T细胞。合成T细胞受体抗原受体(STAR, synthetic T cell receptor and antigen receptor)是一种模拟TCR信号传导的新型受体,更为温和持久,可减少CAR-T细胞耗竭。STAR-T技术由清华大学林欣教授团队于2021年提出,已先后开展CD19、CD19-CD20双靶点SRAR-T细胞临床前期研究。在实体瘤方面,接受GPC3 STAR-T细胞治疗的晚期胃癌患者实现部分缓解,8周评效靶病灶肿瘤从50毫米缩小至35毫米。
2 增强CAR-T细胞功能
转录因子FOXO1过表达能增强CAR-T在体内的持久性和抗肿瘤能力。Nature期刊曾背靠背发表两篇研究文章,证明FOXO1能够帮助CAR-T细胞“延寿”。类似地,过表达c-Jun也可增强CAR-T细胞的增殖潜力和效应功能,在多种实体瘤模型中显著提高疗效。
葡萄糖缺乏、乳酸堆积等肿瘤微环境的代谢压力会造成CAR-T功能受限。“CAR-T之父”Carl June通过敲除两种T细胞炎症调节因子Regnase-1和Roquin-1,将T细胞扩增水平至少提高10倍,增强CAR-T细胞的代谢适应性,使其在缺氧和酸性环境中保持活性。过表达脯氨酸分解代谢途径关键酶PRODH2,可增强CAR-T在实体瘤中的杀伤能力。
3 CAR-T细胞工艺创新
非病毒定点整合CAR-T技术避免基因错误插入风险,提高安全性。邦耀生物自主研发的靶向CD19非病毒PD1定点整合CAR-T细胞注射液(BRL-201)于2022年获得临床试验申请(IND),将CAR基因插到PD-1位点,在B细胞淋巴瘤中具有良好的安全性和疗效。
现货通用型CAR-T可满足“即取即用”,缩短制备周期和降低生产成本。通过敲除β2M和TCRαβ可避免移植物抗宿主病和宿主抗移植物反应。在2024年的AACR大会上,美国MD安德森癌症中心的Samer A. Srour博士报告了1位患者,仅注射1剂CTX130(靶向CD70的通用型CAR-T)就实现完全缓解(CR),且在3年随访中持续CR。
体内(in vivo)CAR-T颠覆传统的生产工艺,利用脂质纳米颗粒或病毒载体将CAR mRNA直接递送到患者体内,避免体外培养的繁琐过程,实现快速制备,为实体瘤紧急治疗提供新思路。可是,我们怎么知道CAR-T细胞在体内生成了呢?请查阅“定点标记蛋白紧随体内CAR-T的步伐,加速细胞免疫治疗开发”。
4 克服肿瘤微环境的限制
趋化因子修饰的CAR-T细胞能够促进细胞渗透和归巢。CXCR2修饰的GPC3 CAR-T细胞在肝细胞癌(HCC)模型中迁移能力显示提高。在晚期HCC患者中注射IL-7和CCL19过表达的GPC3 CAR-T细胞,肿瘤在第30天完全消失。
5 CAR-T安全性
如以上提到的双靶点CAR-T、“装甲型”CAR-T等,引入安全开关,阻断细胞因子相关通路,以降低脱靶毒性。多靶点与逻辑门控设计,实现对复杂抗原表达模式的精准识别,提供更精准的CAR-T疗法。
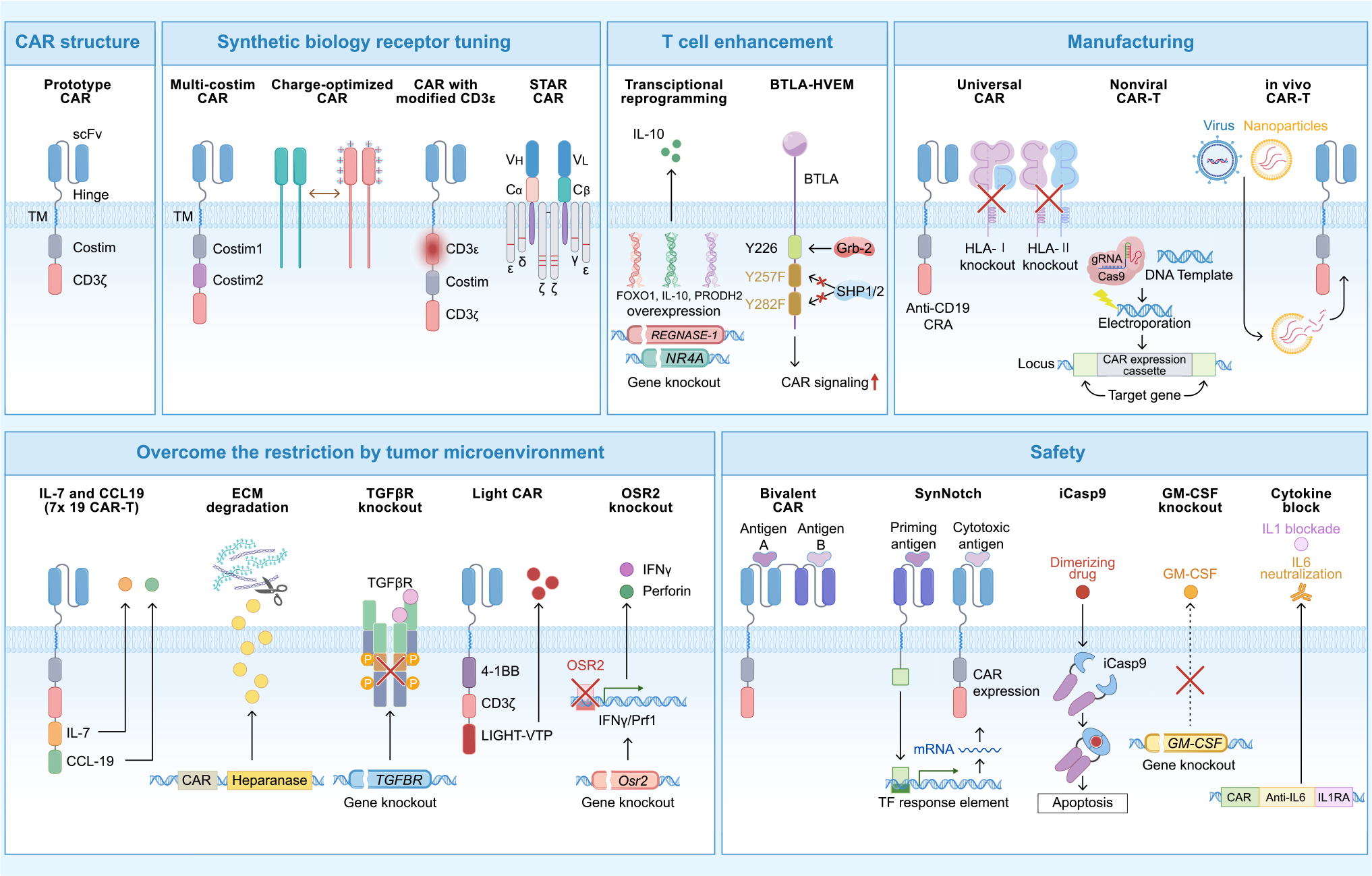
CAR-T克服实体瘤障碍的策略(源自文献:doi: 10.1016/j.ccell.2025.03.019)
探索CAR-T新兴靶点
已有多项CAR-T疗法在实体瘤领域开展临床试验,但多数处于早期阶段,且由医院、高校等科研机构发起,商业化进程相对缓慢。
正在进行肺癌CAR-T研究的抗原靶点有EGFR、MSLN、MUC1、CEA、PD-L1、ROR1、B7H7、HER2等。乳腺癌主要以受体酪氨酸激酶(RTK)家族的特定成员及细胞表面的某些蛋白质为靶点,如HER2、EGFR、c-MET、ROR1等。研究发现,HER2、MUC1、Claudin 18.2、EpCAM、B7H3、NKG2D等可作为胃癌CAR-T细胞疗法的靶点。胰腺癌研究较广泛的靶点有MSLN、HER2、EGFR、CD133等。还有一些靶点用于特定的肿瘤类型。GPC3、AFP、CD147在肝细胞癌中研究较多,GUCY2C、DCLK1多用于结直肠癌研究。
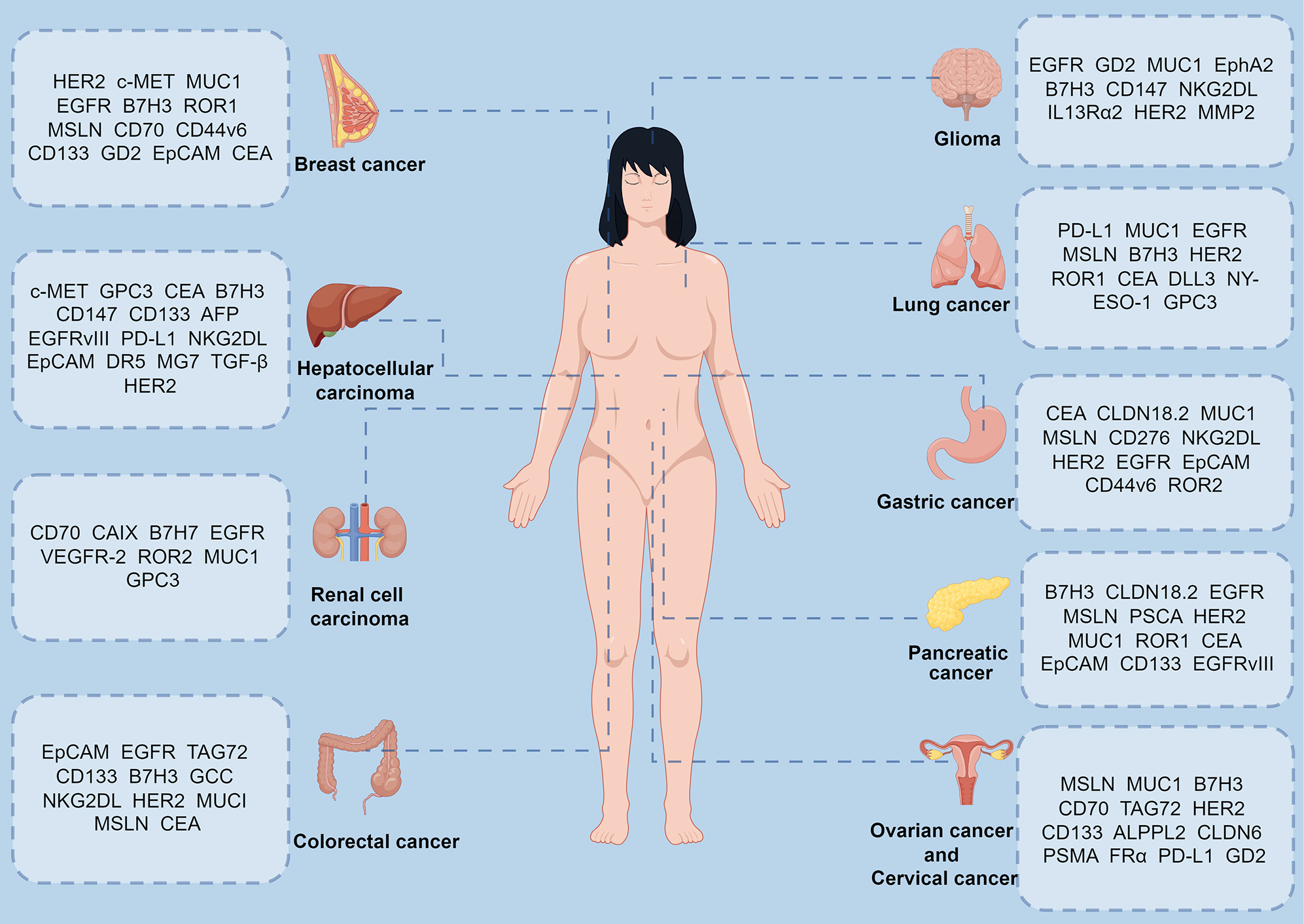
不同实体瘤的CAR-T细胞靶点(源自文献:doi: 10.1186/s12935-024-03315-3)
义翘神州靶点蛋白
义翘神州提供多种类型靶点蛋白,具有高纯度、高活性等特性,助力CAR-T细胞开发。通过VLP、Nanodisc、Detergent三大跨膜蛋白技术平台,自主开发了GPRC5D、Claudin 18.2、SSTR2等多次跨膜靶点蛋白。还提供多种标记类型的靶点蛋白,灵活满足CAR-T不同研发需求。
【参考文献】
1. Bing Du, et al. CAR-T therapy in solid tumors. Cancer Cell. 2025
2. Yitong Li, et al. Advances in CAR-T Cell Therapy for Solid Tumors. Immune Discovery 2025
3. Chen et al. Current challenges and therapeutic advances of CAR-T cell therapy for solid tumors. Cancer Cell International, 2024.
4. Zhu, Jiajun, et al.Advancements and challenges in CAR-T cell therapy for solid tumors: A comprehensive review of antigen targets, strategies, and future directions.Cancer cell international. 2025, doi:10.1186/s12935-025-03938-0