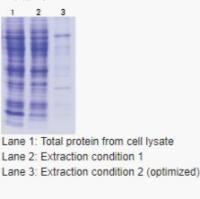
北京义翘神州科技股份有限公司(Sino Biological Inc.)品牌商
17 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
北京义翘神州科技股份有限公司(Sino Biological Inc.)
入驻年限:17 年
- 联系人:
客服部
- 所在地区:
北京
- 业务范围:
技术服务、试剂、抗体、细胞库 / 细胞培养、ELISA 试剂盒
- 经营模式:
生产厂商
推荐产品
公司新闻/正文
里程牌!EGFR抑制剂+双抗联合方案获批,显著延长肺癌患者生存期
1017 人阅读发布时间:2024-09-02 15:58
| 前言 |
| EGFR是抗肿瘤领域最经典的靶点,以其为靶点的小分子抑制剂、单抗、双抗和ADC研究层出不穷,但耐药性接踵而来。本文就EGFR结构、耐药机制和药物研发情况进行综述,以期设计出更优秀的药物,使更多患者获益。 |
| EGFR的激酶活性 |
表皮生长因子受体(EGFR)属于酪氨酸蛋白激酶ERBB家族成员,是由胞外域、跨膜域、胞内域组成的跨膜糖基化蛋白。其中胞内域包含近膜端结构域、酪氨酸激酶结构域和C末端尾部,C末端尾部包含5个自磷酸化基序。
EGFR在正常细胞普遍表达,但表达量不高,对细胞的生长、增殖、分化等具有重要作用。EGFR突变或过表达一般会引发肿瘤,因此在多种肿瘤中高表达,如肺癌、胰腺癌、鼻咽癌等。
EGFR具有酪氨酸激酶活性。与配体EGF或TNF-α等结合时,EGFR激酶结构域不对称的形成同源或异源二聚体。二聚化构象中,EGFR酪氨酸激酶结构域在ATP的存在下磷酸化,并触发细胞质调节域中特定酪氨酸的自动磷酸化,激活下游信号通路。
EGFR主要激活以下3条信号通路:
1. Ras-Raf-Erk通路。EGFR磷酸化后与生长因子受体结合蛋白GRB2形成复合物,激活Ras,活化的Ras激活下游丝/苏氨酸蛋白激酶Raf,使Erk1/2磷酸化,启动靶基因的转录,最终影响细胞增殖和细胞周期。
2. PI3K-AKT/PKC-NF-kB通路。磷酸化的EGFR能够激活PI3K激酶,进而活化蛋白激酶B(AKT)或蛋白激酶C。AKT的激活能激发一系列与细胞生存、抗凋亡有关的反应。
3. JAK/STAT通路。JAK是Janus家族蛋白酪氨酸激酶,活化后通过STAT磷酸化,诱导与生长相关的基因转录,导致细胞增殖和抑制凋亡。
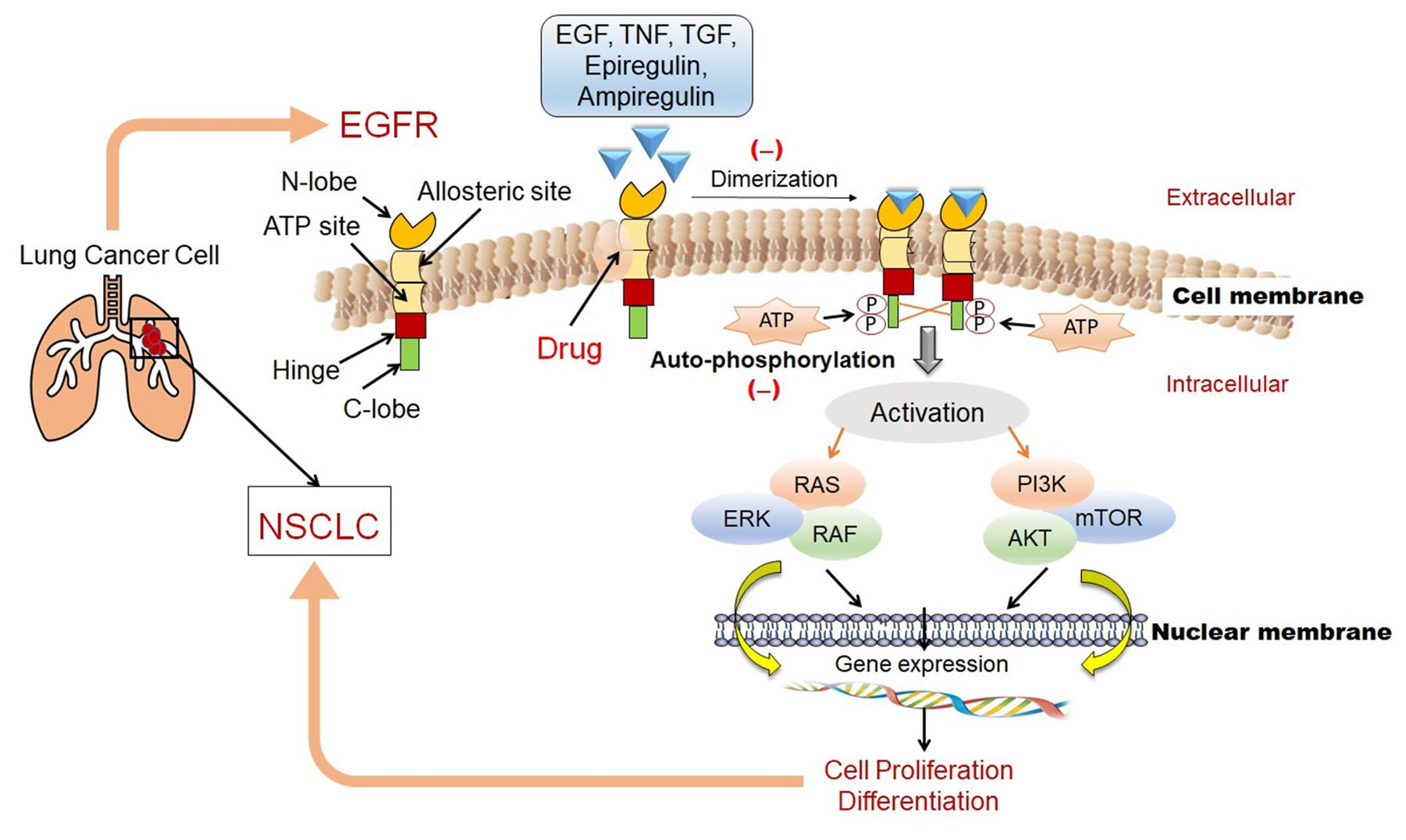
EGFR信号通路及其NSCLC作用机制
(源自文献:doi: 10.1007/s43440-020-00131-0)
| EGFR信号通路关键靶点或激酶 |
| mTOR |
mTOR分子量为289kDa,高度保守,属于PI3K蛋白激酶家族。TOR的C末端与PI3K的催化结构域高度同源。mTOR在参与控制细胞生长和增殖的信号通路中起中心作用,是肿瘤治疗的重要靶点之一。
| MAPK7 |
MAPK7属于MAP激酶家族。MAP激酶作为多种生物化学信号的整合点,参与多种细胞过程,如增殖、分化、转录调控和发育。该激酶被丝裂原活化蛋白激酶激酶5(MAP2K5/MEK5)特异性激活。它参与多种受体分子的下游信号传导过程,包括受体类型激酶和G蛋白偶联受体。在响应细胞外信号时,该激酶易位到细胞核,通过磷酸化和激活不同的转录因子来调节基因表达。
| AKT |
AKT属于丝氨酸/苏氨酸激酶,又称蛋白激酶B(PKB),是经典信号通路PAM中的关键分子,参与调控肿瘤细胞的增殖、分化和凋亡等过程,Akt信号通路与恶性肿瘤、糖尿病、类风湿关节炎等多种疾病的发生发展密切相关,是抗肿瘤药物研发关注的重要信号通路之一。
| BRAF |
BRAF蛋白与KRAS蛋白同为RAS-RAF-MEK活化的细胞外信号调节激酶,在MAPK/ERK信号通路中起着关键作用。BRAF V600E突变(占BRAF所有突变的80%)使其持续激活,活性提高约500倍,并且能够不依赖于上游RAS激酶,持续激活下游的ERK,最终导致细胞的无限增殖和分裂。
| STAT3 |
STAT3是一种信号转导转录调节因子,是细胞中参与大量细胞因子及生长因子应答的信号转导蛋白,是细胞在认知环境信号、细胞内信息传递以及基因表达方面的关键参与者,也是诸多信号通路的交汇点。STAT3广泛存在于各类细胞和组织中,能够被多种细胞因子激活。STAT3通常被认为是一种致癌基因,其信号通路的激活与癌症的发生、发展、转移和治疗抵抗性等密切相关。
EGFR酪氨酸激酶活性受多种因素影响。正常情况下,EGFR蛋白以没有激酶活性的单体存在。在细胞增殖过程中,EGFR单体与配体结合,形成具有磷酸激酶活性的二聚体。此二聚体含有ATP结合位,能够与ATP结合,使二聚体发生自身磷酸化,进而促进细胞增殖、分化和迁移。当EGFR基因突变、基因拷贝数增加或蛋白过度表达时,EGFR单体不依赖配体而形成具有磷酸激酶活性的二聚体,造成肿瘤细胞的增殖和迁移。
EGFR激酶区有3个结合位点,分别是ATP结合位点、变构结合位点、失活位点。失活位点无法被小分子靶向。
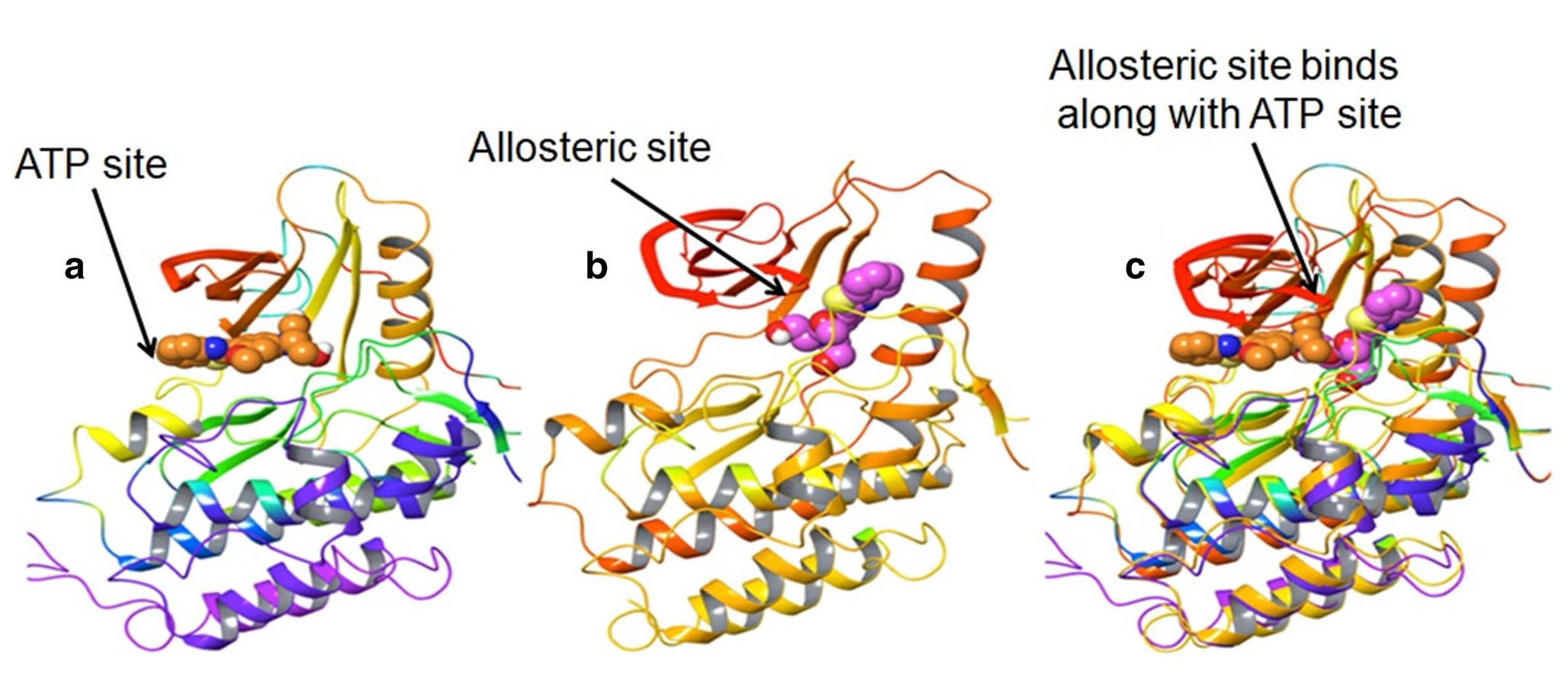
EGFR抑制剂结合位点
(源自文献:doi: 10.1007/s43440-020-00131-0)
基于以上机理开发出了EGFR小分子抑制剂(EGFR-TKIs)。其与ATP竞争结合,阻止酪氨酸激酶利用ATP进行磷酸化,进而抑制EGFR对下游信号通路的激活作用,靶向消灭肿瘤细胞。目前已获批上市的EGFR-TKIs均为此类,即ATP竞争性抑制剂。目前有临床前报道的EGFR-TKIs还有变构抑制剂和双靶向抑制剂(同时结合ATP和变构位点)。
| 耐药与迭代 |
相较于化疗,EGFR-TKIs具有更高的靶向选择性和更低的毒性。目前靶向EGFR敏感突变的EGFR-TKIs已有三代用于临床,第四代正在研发中。其中第一代TKIs与EGFR蛋白ATP结合位为可逆结合,第二代和第三代为不可逆结合。
EGFR-TKIs耐药是一个持续存在的问题。每一代耐药机制基本相似,主要包括:1)继发性耐药突变,如T790M;2)旁路及下游通路激活,如HER2扩增、Met扩增等。3)组织类型转化,如TP53、RB1失活转化为小细胞肺癌。
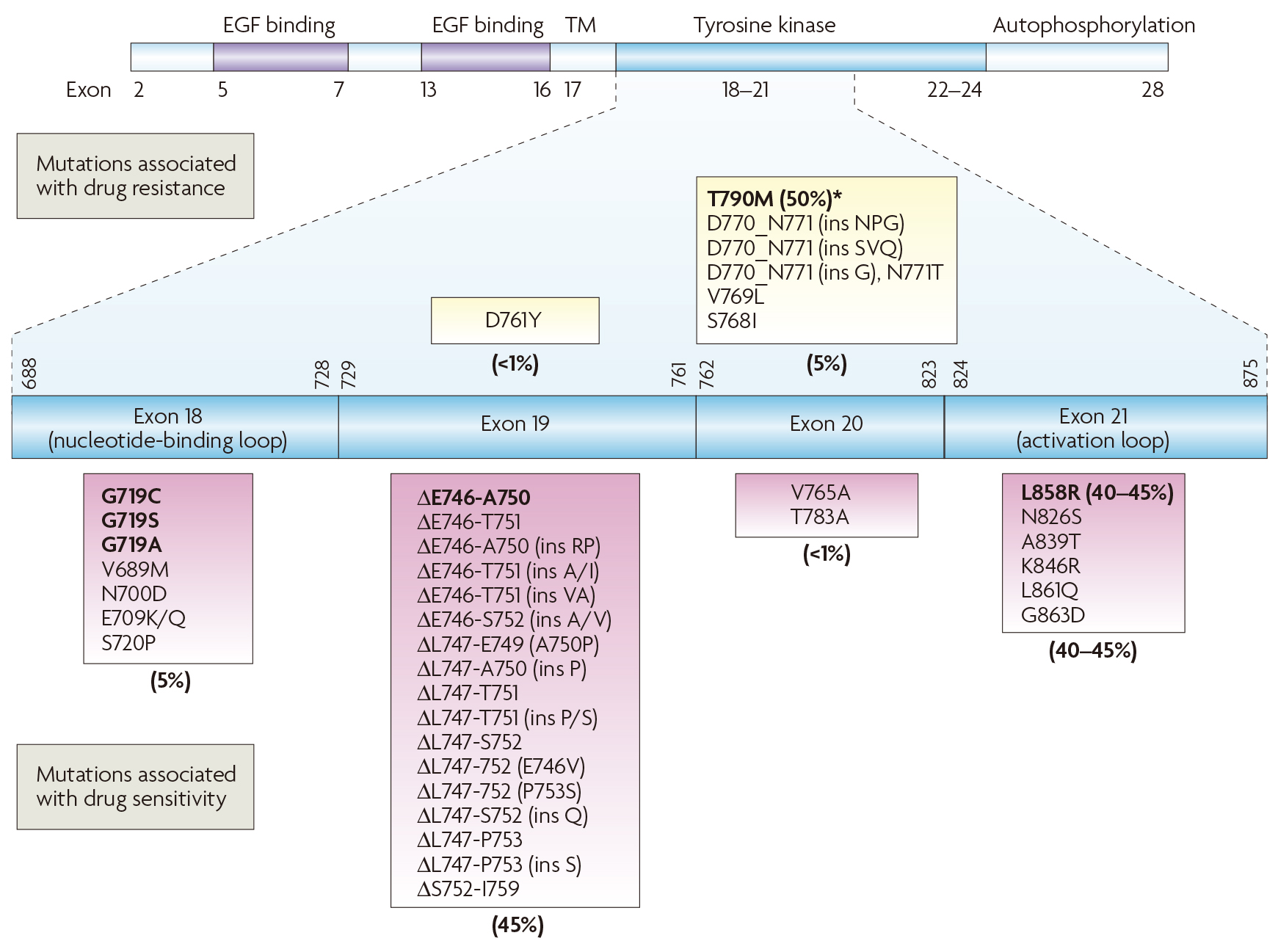
NSCLC中第一代EGFR-TKIs出现的耐药突变
(源自文献:doi:10.1038/nrc2088)
EGFR-TKIs的迭代更新是为了解决上一代药物的耐药难题。以奥希替尼(Osimertinib)为代表的第三代TKIs成功解决了第一代和第二代的T790M突变耐药,但奥希替尼出现新的耐药。EFGR依赖性耐药包括C797S、G796D、G724S、L718Q突变、EGFR扩增等,非EFGR依赖性耐药包括旁路或下游信号通路激活(如MET、HER2、RET、PIK3CA、K-RAS等突变)。
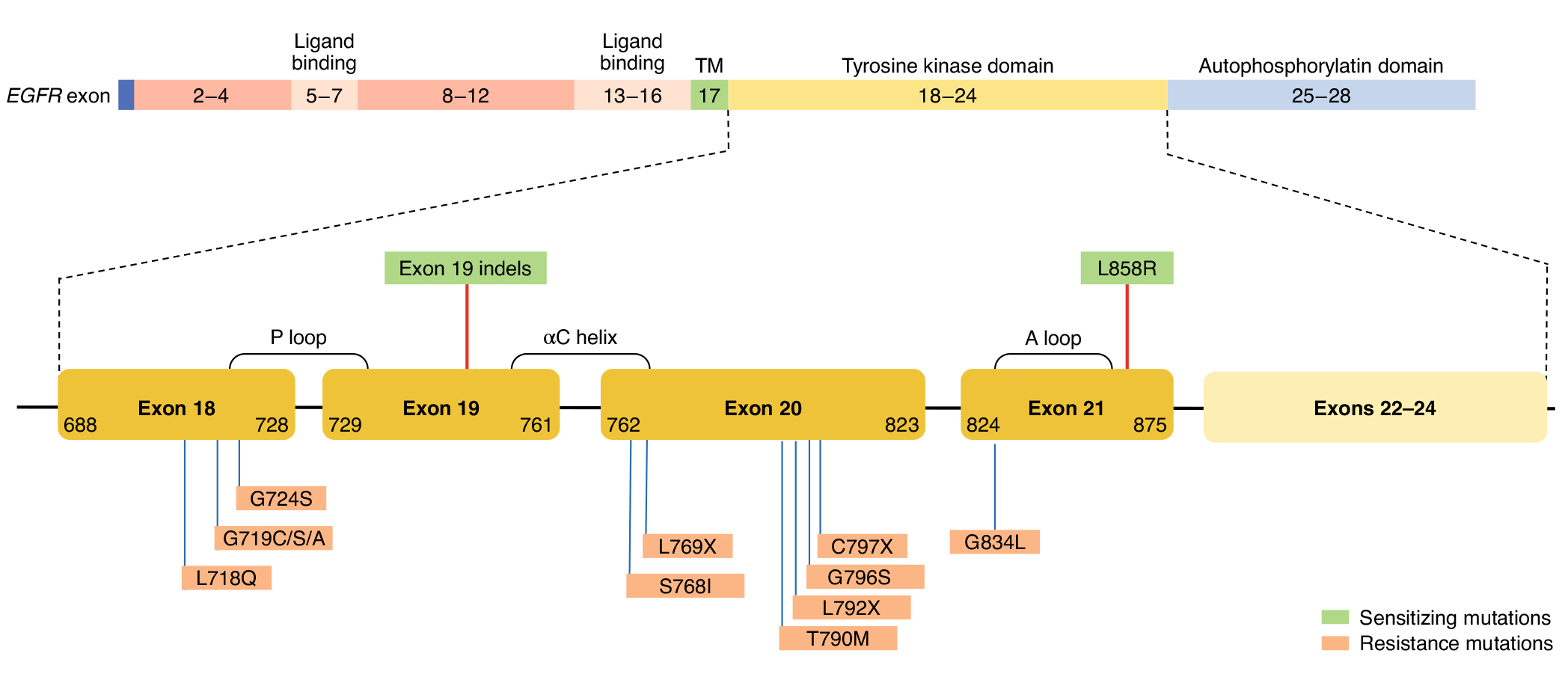
奥希替尼治疗后的EGFR依赖性突变
(源自文献:doi: 10.1038/s43018-021-00195-8)
| 克服耐药,联合出击 |
第三代EGFR-TKI耐药机制复杂多样,涉及到一系列突变和信号通路改变,耐药后的治疗选择极具挑战。开发高亲和力的可逆性抑制剂或异位抑制剂是第四代EGFR-TKI研发的主要思路。然而新药研发速度远远不及耐药发生速度,且新药物的应用仍然无法避免新的耐药出现。因此联合用药可能是克服或延迟获得性耐药出现的有效策略。
克服第三代EGFR-TKI耐药,联合方案层出不穷,主要包括EGFR-TKIs联合化疗、放疗、抗血管生成药物、其他靶向药物、免疫抑制剂、新型免疫药物(如ADC)等。
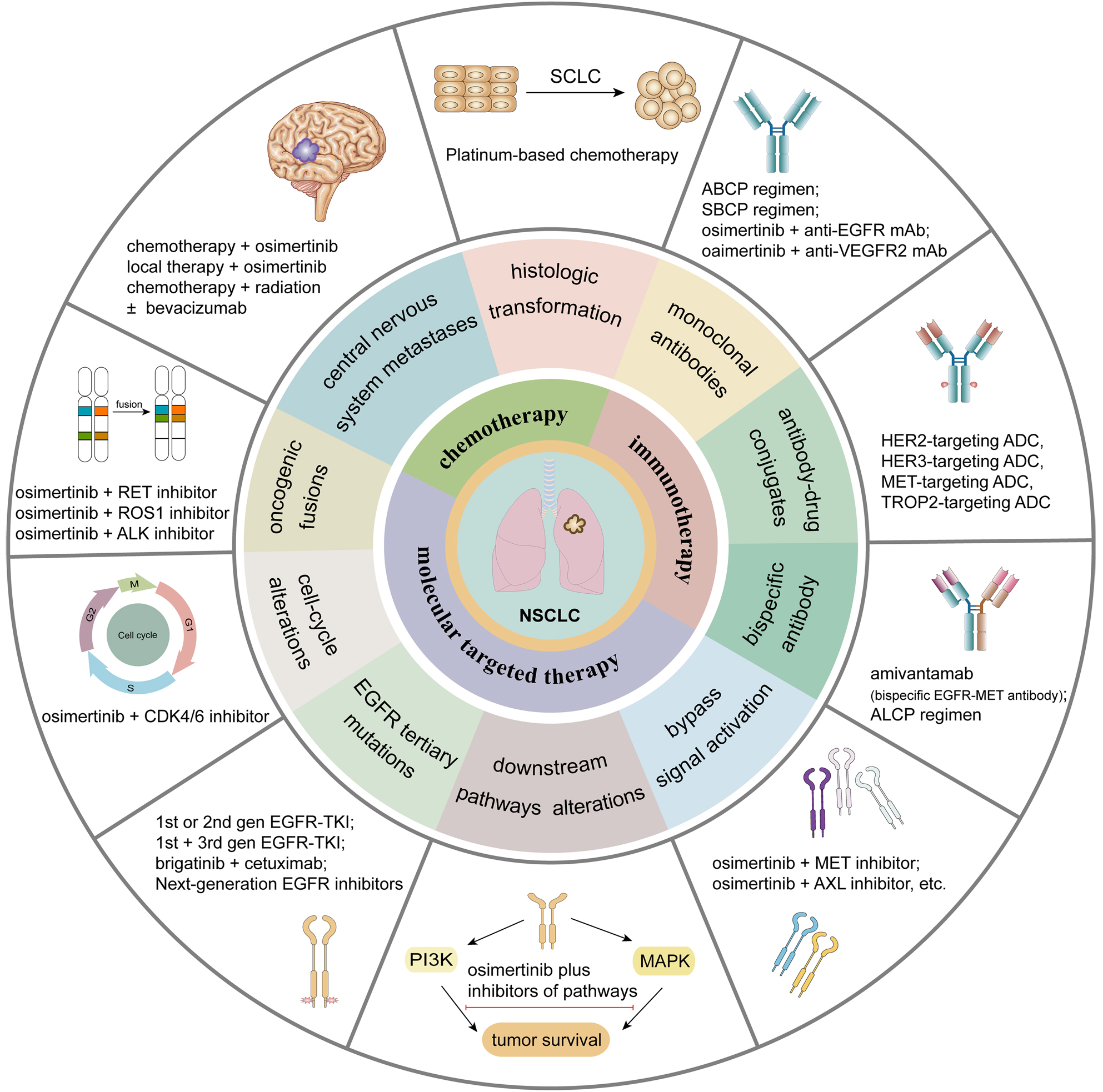
奥希替尼联合治疗策略
(源自文献:doi: 10.1186/s13045-022-01391-4)
奥希替尼联合化疗于2024年2月和6月先后获FDA和NMPA批准,用于治疗局部晚期或转移性EGFR突变(EGFRm)非小细胞肺癌(NSCLC)成人患者。获批主要基于FLAURA2临床3期试验结果。
奥希替尼联合化疗可将疾病进展或死亡风险降低38%。无论是根据研究者评估还是盲法独立中央评审(BICR),联合疗法的中位无进展生存期(PFS)比奥希替尼单药组约延长9个月。其中,两组根据研究者评估的PFS分别为25.5个月对16.7个月,BICR为29.4个月对19.9个月。
里程碑!不用化疗,EGFR-TKI联合双抗疗法获批上市。
2024年8月20日,强生宣布第三代EGFR抑制剂Lazcluze(Lazertinib,兰泽替尼)与EGFR/c-Met双抗Rybrevant(amivantamab-vmjw,埃万妥单抗)联合方案获美国FDA批准,用于一线治疗局部晚期或转移性NSCLC成年患者。
Lazertinib是一种口服高选择性、脑渗透性的第三代EGFR抑制剂。Rybrevant是一种靶向EGFR和MET的全人源双特异性抗体,具有免疫细胞定向活性。联合方案是直接针对两种常见EGFR突变的多靶点方案。
批准基于III期MARIPOSA研究的积极结果。该研究头对头对比兰泽替尼+埃万妥单抗(laz+ami)联合方案与奥希替尼一线治疗EGFR突变局部晚期或转移性NSCLC患者的疗效和安全性。结果显示,联合方案降低了30%的疾病进展或死亡风险,无进展生存期(PFS)为23.7个月vs 16.6个月。在次要终点,联合方案治疗患者中位缓解持续时间(DOR)延长了9个月(25.8个月vs 16.7个月)。同时数据显示,在24个月时联合方案组和奥希替尼组分别有75%和70%的患者存活,36个月时,相应存活率分别为61%和53%。
总之,EGFR抑制剂不断迭代更新,在治疗具有致癌基因依赖性的NSCLC中具有显著优势,但如何突破有限的适用范围、探索潜在的联合用药方案、克服耐药突变难题等等,是新一代抑制剂开发的挑战和机遇。期待未来有更多靶向其他突变的TKIs研发和上市,为更多患者提供有效的治疗方案。
|
SignalChem Biotech(义翘神州全资子公司) EGFR激酶特色产品 |
作为全球激酶蛋白重要供应商,SignalChem Biotech(义翘神州全资子公司)拥有超过20年酶蛋白开发和生产经验。为支持EGFR抑制剂的开发,提供多种高活性、高纯度EGFR蛋白,推动肿瘤药物开发的发展。

【参考文献】
1.Maity, S., Pai, K.S.R. & Nayak, Y. Advances in targeting EGFR allosteric site as anti-NSCLC therapy to overcome the drug resistance. Pharmacological Reports, 2020.
2.Sharma, S., et al. Epidermal growth factor receptor mutations in lung cancer. Nat Rev Cancer, 2007.
3.Kai Fu, et al. Therapeutic strategies for EGFR-mutated non-small cell lung cancer patients with osimertinib resistance. J Hematol Oncol, 2022. doi: 10.1186/s13045-022-01391-4.
4.Passaro, A., et al. Overcoming therapy resistance in EGFR-mutant lung cancer. Nat Cancer, 2021.
5.Amelia T, et al. Structural Insight and Development of EGFR Tyrosine Kinase Inhibitors. Molecules. 2022. doi: 10.3390/molecules27030819.
6.Sabbah DA, Hajjo R, Sweidan K. Review on Epidermal Growth Factor Receptor (EGFR) Structure, Signaling Pathways, Interactions, and Recent Updates of EGFR Inhibitors. Curr Top Med Chem. 2020. doi: 10.2174/1568026620666200303123102.
7.相关公司官方新闻