北京义翘神州科技股份有限公司(Sino Biological Inc.)品牌商
17 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
北京义翘神州科技股份有限公司(Sino Biological Inc.)
入驻年限:17 年
- 联系人:
客服部
- 所在地区:
北京
- 业务范围:
技术服务、试剂、抗体、细胞库 / 细胞培养、ELISA 试剂盒
- 经营模式:
生产厂商
推荐产品
公司新闻/正文
受体酪氨酸激酶知多少:探索肿瘤靶向治疗的关键靶点
754 人阅读发布时间:2024-08-15 16:02

前言
截止到2023年底,FDA批准靶向蛋白激酶的治疗药物有80种,针对24种不同的激酶,其中有43种靶向受体酪氨酸激酶(RTKs)。
那么,受体酪氨酸激酶(Receptor tyrosine kinases, RTKs)是什么呢?在肿瘤的发生发展中起到哪些作用呢?RTK异常激活的机制有哪些呢?小分子抑制剂的发展情况如何?
本文将与大家共同进入受体酪氨酸激酶的世界,共同分享其与肿瘤的关系。
RTKs初相识:受体+激酶
蛋白激酶(Protein Kinases)是催化蛋白质磷酸化的酶,参与调控细胞生长、分化、凋亡等关键细胞过程。在人体中已发现518种激酶(约50个家族),形成了错综交错的网络。
受体酪氨酸激酶(RTKs)属于蛋白激酶的一类。RTKs由三个部分组成:细胞外结构域(含有配体结合位点)、跨膜区域(单次疏水α螺旋)及胞内结构域(具有酪氨酸蛋白激酶活性),示意图如下。
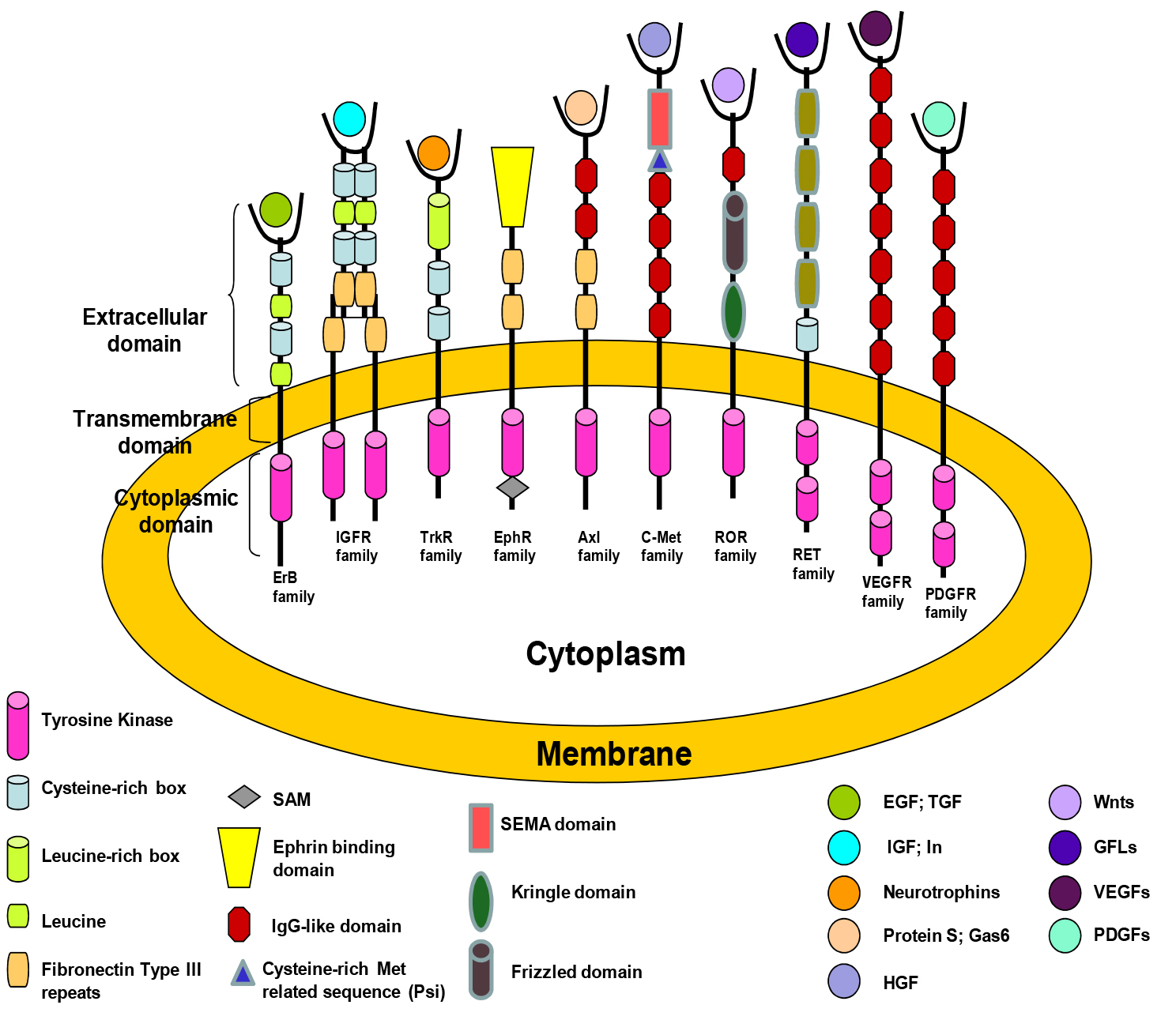 人RTKs家族
人RTKs家族
(源自参考文献:doi: 10.5772/36012)
受体酪氨酸激酶由60多种跨膜蛋白亚型组成,是细胞因子、生长因子、激素和其他信号分子的受体,包括EGFR家族、IGFR家族、TrkR家族、MCSFR家族、INSR家族、NGFR家族、FGFR家族、VEGFR家族、HGFR家族等。
RTKs不仅是多种细胞因子、生长因子的受体,还具有将酪氨酸磷酸化的激酶活性。
正常生理过程中,RTKs的激活机制大致相同:配体(EGF、FGF、PDGF等)结合RTK胞外结构域后,两个RTK分子首先在膜上发生二聚化。二聚化后,RTK蛋白构象发生改变,ATP可以进入其中一个RTK的催化位点,并发挥激酶活性催化另一个RTK磷酸化。然后激活MAPK、PI3K/AKT和JAK/STAT等信号通路,在细胞增殖、存活、迁移和血管生成等功能中发挥重要作用。
RTKs持续激活:肿瘤发生
RTKs是正常细胞不可或缺的,其功能障碍与多种疾病有关。RTKs异常激活会破坏细胞生长增殖与死亡之间的平衡,最终导致恶性肿瘤的发生、发展或转移,从而引发乳腺癌、肺癌和结直肠癌等多种恶性肿瘤。
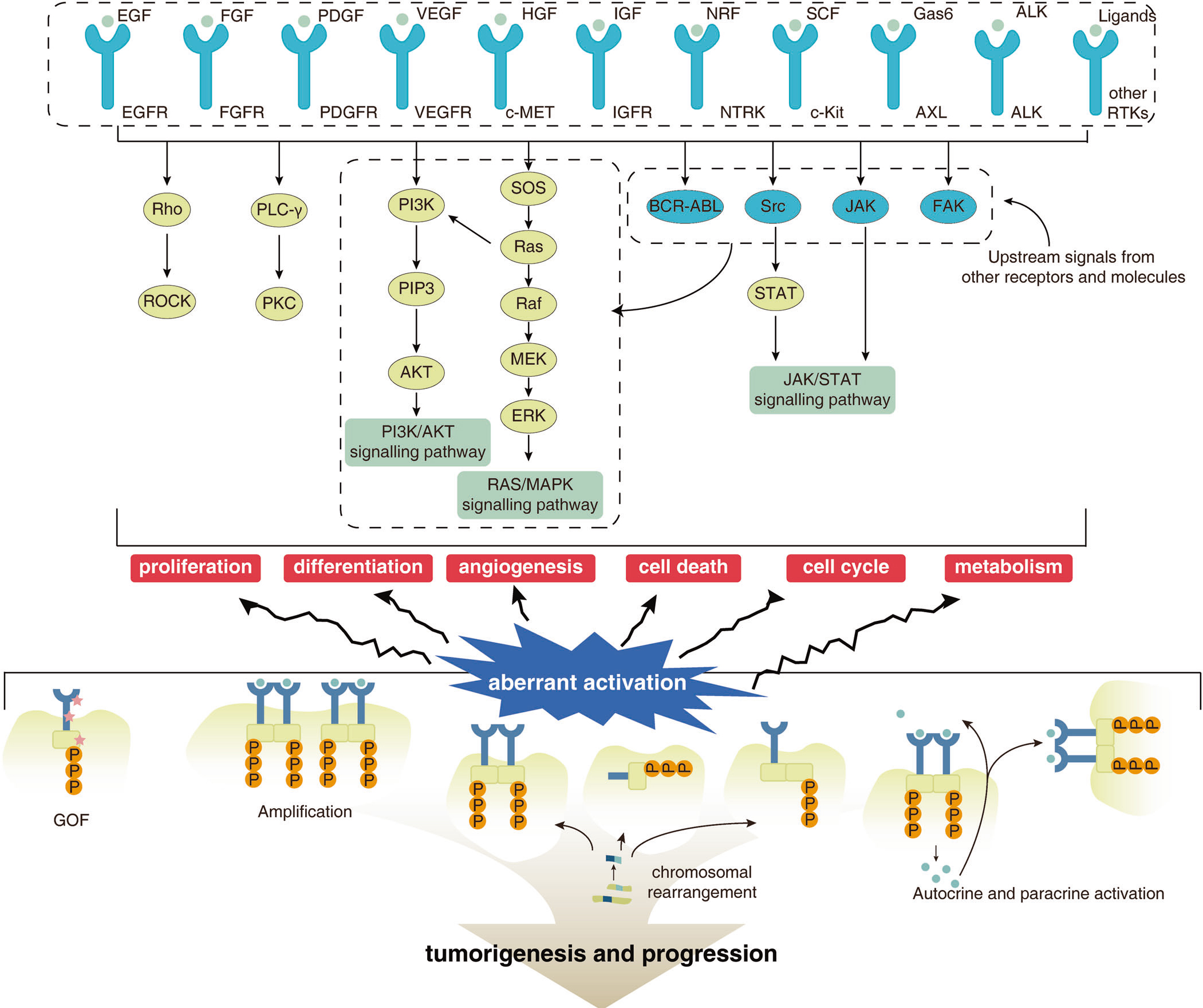
RTKs与肿瘤关系
(源自参考文献:doi: 10.1038/s41392-022-01168-8)
从图中我们可以看出,多种机制能够引起RTKs的异常激活,主要有4种:功能获得性突变、基因组扩增、染色体重排和自分泌激活。在基因组扩增中包含一种特殊的激酶结构域重复(KDD)。
RTK异常激活机制
1 功能获得性突变(GOF, gain-of-function mutation)
RTK功能获得性突变导致下游信号转导异常,不受生理信号的调控。比如赋予细胞选择性生长优势的“驱动突变”,有助于识别癌症发生,为靶向治疗提供潜在靶点。突变通常发生在保守残基中,例如激酶激活环DFG基序和核苷酸结合袋周围。突变可能发生在RTK的激酶区(KD),也可能在胞外域(ECD)、跨膜域(TMD)和膜外结构域(JMD)。
TKI的治疗效果与突变位点有关。比如在胶质母细胞瘤(GBM),EGFR ECD发生三个错义突变(P596L、G598V和A289V),与肺癌患者的EGFR突变存在差异,造成GBM患者在接受EGFR TKI、厄洛替尼和吉非替尼治疗时临床结果令人失望。
2 过表达与基因组扩增(Amplification)
多种RTKs在多种癌症中过表达,如EGFR在GBM、肺癌、食管癌、甲状腺癌中过表达,HER2在肺癌、乳腺癌、胃癌中过表达。过表达导致RTK局部浓度增加,造成调节机制失衡。基因组扩增是导致RTKs过度表达的主要机制,除此之外还有转录/翻译增强、癌基因病毒、正常调节机制脱轨等。
基因扩增的特点是基因组特定区域的拷贝数增加。人类癌症中报道的常见扩增激酶包括EGFR、ERB2和MET等,其他如肺癌和乳腺癌中的FGFR1、乳腺癌和膀胱癌中的FGFR3、乳腺癌和胃癌中的ERB4、结肠癌FLT3、黑色素瘤中KIT和GIST、GBM中的PDGFRA等。
3 染色体重排(Chromosomal rearrangements)
RTK融合是BCR-ABL,将9号染色体上编码ABL1激酶的基因与22号染色体上的BCR基因融合,形成BCR-ABL融合蛋白,并特征性的表达于慢性粒细胞白血病(CML)和一些急性淋巴细胞白血病患者中。这就是第一款被FDA批准上市的TKI--伊马替尼作用机制,靶向抑制BCR-ABL融合蛋白表达。自此之后,靶向药物研发进入加速阶段,开启了TKI靶向抗肿瘤药物的黄金时代。
除了BCR-ABL,还有NPM-ALK融合、ROS1融合、RET融合等。激酶融合的另一个特征是在同一疾病中出现多个融合伙伴,如在NSCLC中至少发现了9个已知的ROS1融合伙伴,包括SLC34A2、CD47、TPM3、SDC4、EZR、LRIG3、FIG、KDELR2和CCDC6等。
尽管融合形式不同,但具有三个共同特点。首先,融合伙伴调节融合蛋白的表达,酪氨酸激酶癌蛋白位于融合伙伴的内源性启动子下;第二,大多数融合伙伴贡献一个寡聚结构域,促进激酶的非配体组成性激活;第三,融合伙伴决定融合蛋白的亚细胞定位,这可能影响融合蛋白的激活、信号、功能和降解等。
4 激酶结构域重复(KDD, kinase domain duplication)
基因内部分复制是一种染色体重排,赋予癌细胞获得新的蛋白质异构体的能力。激酶结构域复制(KDDs)是基因内部分复制的一种,为肿瘤细胞RTK的激活提供了一种新的机制,如EGFR-KDD和BRAF-KDD。
EGFR-KDD在NSCLC中反复被发现,也出现在胶质瘤、肉瘤和肾母细胞瘤等肿瘤中。BRAF-KDD在胶质瘤和晚期腺泡细胞瘤中已有报道。
研究人员分析了114200例人类肿瘤的临床基因组数据,发现涉及多种激酶KDD,包括ErbB家族(EGFR、ERBB2和ERBB4)、FGFR家族(FGFR1、FGFR2和FGFR3)、NTKR家族(NTRK1和NTRK2)、PDGFR家族(PDGFRA和PDGFRB)和其他激酶(BRAF、RET、,MET、ROS1、ALK和KIT)。在脑肿瘤中,KDD常见于EGFR、BRAF、PDGFRA和FGFR3。在颅外肿瘤中,KDD经常出现在RET、MET和ALK基因中。总的来说,KDD的频率为0.62%。
5 自分泌激活(Autocrine)
在多种癌症中发现RTK的自分泌激活,包括TGFα-EGFR、HGF-MET、SCF-KIT等自分泌回路。RTK自分泌环与其它自分泌生长途径协同作用,促进肿瘤的发展。
自分泌途径可作为癌症治疗的潜在靶点,如配体/受体自分泌使EGFR突变的肺癌细胞对EGFR TKI产生耐药性。
TKIs:抑制肿瘤
受体酪氨酸激酶在细胞信号传导和肿瘤发生中的作用,使其在癌症治疗中至关重要。针对RTK的治疗药物包括单克隆抗体和小分子抑制剂。单克隆抗体通过靶向RTK的细胞外结构域阻断配体结合,而小分子抑制剂则通过靶向细胞内激酶结构域抑制其活性。
酪氨酸激酶抑制剂(Tyrosine kinase inhibitor, TKI)是主要的肿瘤靶向治疗类药物。
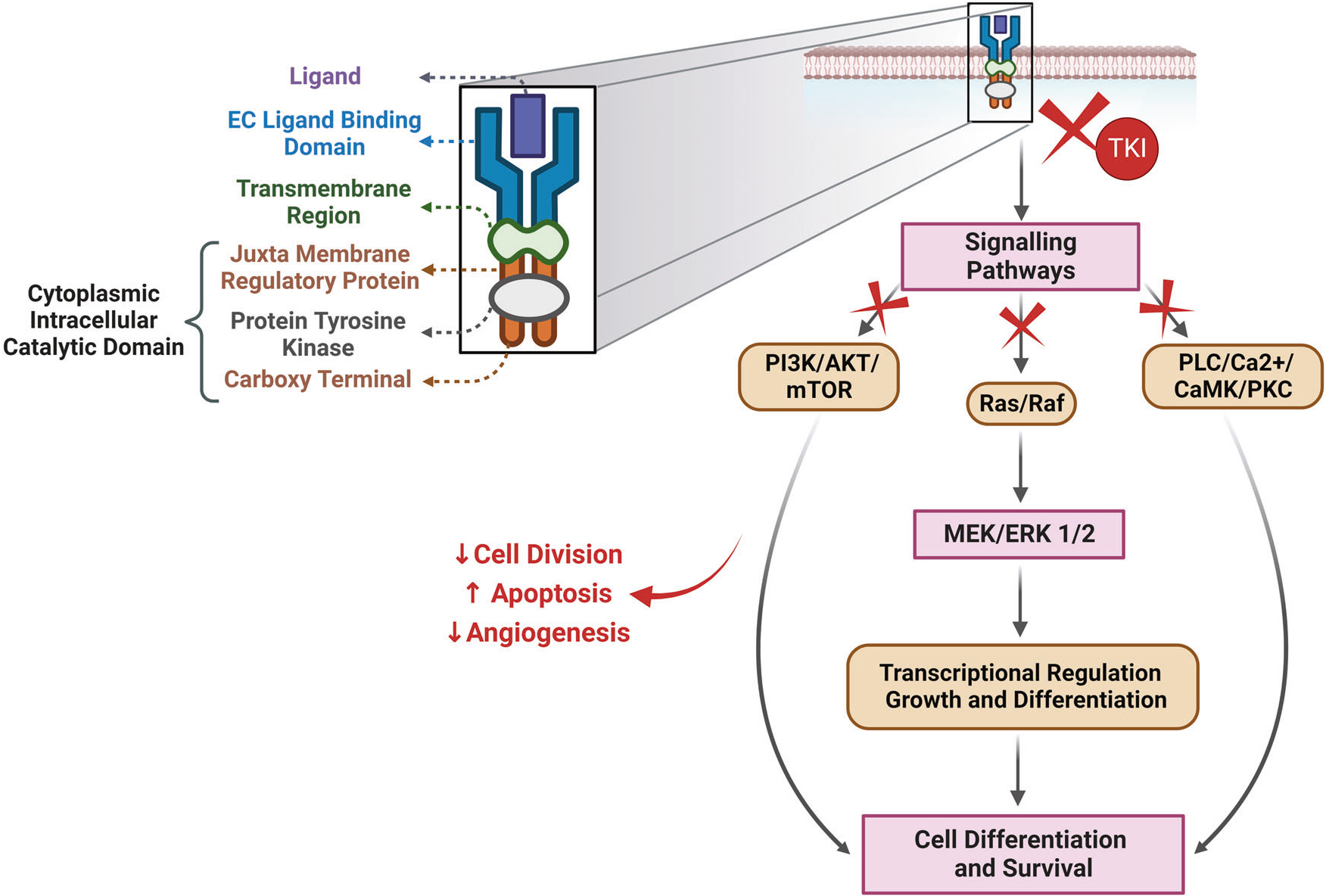
TKIs的作用机制
(源自参考文献:doi: 10.1038/s41392-023-01469-6)
在过去的二十多年里,已经开发出多种具有单一或多个靶点的稳健且耐受良好的TKIs,主要靶点包括EGFR、VEGFR、PDGFR、KIT、ALK、ROS1、HER2、NTRK、RET、MET、MEK及FGFR等。如EGFR-TKI发展至今已出现“三代”同堂的局面,国内应用于临床的EGFR-TKI共有10个品种,成为EGFR突变晚期NSCLC患者的标准治疗选择。ALK TKI用于治疗ALK阳性的非小细胞肺癌(NSCLC)和淋巴瘤,AXL TKI已被批准用于治疗甲状腺癌、肾细胞癌和急性髓性白血病(AML),c-Kit TKI胃肠道间质瘤和急性髓性白血病有效。
从实验室到临床的进展凸显了受体酪氨酸激酶在开发个性化癌症疗法中的关键作用,显著提高了诸如肺癌、肝癌、胃肠道间质瘤、乳腺癌和甲状腺癌等患者的生存率和生活质量,将肿瘤治疗从化疗时代推向个体化精准治疗的靶向治疗时代!

| SignalChem Biotech(义翘神州全资子公司) 特色受体酪氨酸激酶产品 |
|||
|---|---|---|---|
| 分子 | 货号 | 标签 | 活性 |
| Her2/ERBB2 | E27-11G | GST | Active |
| HER3/ERBB3 | E28-35H | His | Active |
| VEGFR1/FLT1 | F11-11G | GST | Active |
| VEGFR2/KDR | K01-11G | GST | Active |
| VEGFR3/FLT4 | F13-11G | GST | Active |
| EGFR | E10-112H | His | Active |
| EGFR1 | F04-11G | GST | Active |
| EGFR2 | F05-11G | GST | Active |
| EGFR3 | F06-11G | GST | Active |
| EGFR4 | F07-11G | GST | Active |
【参考文献】
1.Yanlin Song, Targeting RAS-RAF-MEK-ERK signaling pathway in human cancer: Current status in clinical trials. Genes & Diseases, 2023.
2.Anica Dricu, et al. Epigenetic Alteration of Receptor Tyrosine Kinases in Cancer. In book: DNA Methylation - From Genomics to Technology.
3.Yang Yang, et al. Protein tyrosine kinase inhibitor resistance in malignant tumors: molecular mechanisms and future perspective. Signal Transduction and Targeted Therapy, 2022.
4.Sudhesh Dev S, et al. Receptor Tyrosine Kinases and Their Signaling Pathways as Therapeutic Targets of Curcumin in Cancer. Front. Pharmacol. 2021. doi: 10.3389/fphar.2021.772510
5.Zhenfang Du and Christine M. Lovly. Mechanisms of receptor tyrosine kinase activation in cancer. Molecular Cancer, 2018.
6.Robert Roskoski, Properties of FDA-approved small molecule protein kinase inhibitors: a 2024 update, Pharmacological Research, 2024.
Li, J. et al. Kinase Inhibitors and Kinase-Targeted Cancer 7.Therapies: Recent Advances and Future Perspectives. Int. J. Mol. Sci. 2024.
8.Sunitha Shyam Sunde, Umesh C. Sharma and Saraswati Pokharel. Adverse effects of tyrosine kinase inhibitors in cancer therapy: pathophysiology, mechanisms and clinical management. Signal Transduction and Targeted Therapy, 2023.