北京义翘神州科技股份有限公司(Sino Biological Inc.)品牌商
17 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
北京义翘神州科技股份有限公司(Sino Biological Inc.)
入驻年限:17 年
- 联系人:
客服部
- 所在地区:
北京
- 业务范围:
技术服务、试剂、抗体、细胞库 / 细胞培养、ELISA 试剂盒
- 经营模式:
生产厂商
推荐产品
公司新闻/正文
恭喜!国内干细胞新药上市申请获受理
6592 人阅读发布时间:2024-07-08 16:27
2024年6月27日,铂生卓越生物科技(北京)有限公司自主研发的“艾米迈托赛注射液”,成为全国获得中国国家药品监督管理局(NMPA)新药上市申请正式受理并纳入优先审评品种的干细胞新药(受理号:CXSS2400062)。义翘神州对于这一重要里程碑事件表示热烈祝贺!
受铂生卓越生物科技(北京)有限公司委托,义翘神州为本项目样品提供了生物安全检测服务,并出具了服务报告。
▲国家药品监督管理局:铂生卓越干细胞“艾米迈托赛注射液”获新药上市申请受理
义翘神州是国内蛋白、抗体研发生产专家,专注于为生命科学研究和创新药物研发领域提供全面、高质量的重组蛋白和抗体等生物试剂及专业、一站式的技术服务。
义翘神州生物安全检测服务平台中的细胞库检测实验室为生物安全二级实验室,且通过CNAS和CMA认证。实验室按照GMP和GLP质量体系运行,B+A环境,满足无菌检测、分枝杆菌检测环境要求。
义翘神州拥有经验丰富的检测团队,依据药典方法及ICH、FDA及其它监管法规,可根据客户的不同申报需求,提供最佳的细胞库检定方案,以更好地帮助客户完成中外申报。
义翘神州细胞库检定优势
- 支持中外双报,满足出海需求。
- 双中心:北京和苏州双检测中心4200m²,就近服务和支持生物医药公司。
- 多经验:已承接项目1500+,共计4000+个样品。已助力众多公司完成IND和BLA申报,申报成功率100%。
- 周期短:3-4个月(最快10周)
在MCB、WCB和3批EOPC全检的情况下3-4个月即可全部完成检测。 - 通量大:北京和苏州每月检测能力可达1000个检项
细胞库检测服务范围
义翘神州可提供主细胞库(MCB)、工作细胞库(WCB)、收获液 (UPB)、生产终末细胞(EOPC)的细胞库检定服务。细胞库检测方法成熟,符合药典等法规的要求,且经过严格的方法学验证。
检测范围:
CHO细胞、293细胞、干细胞、检定用细胞、原材料检定、昆虫细胞、大肠杆菌菌株鉴定
细胞库检测服务内容
义翘神州遵循NMPA、FDA、EMA、ICH等多个国内外法规和指导原则,建立了全面的细胞库检定方法。义翘神州提供的检测项目和方法描述见下表:
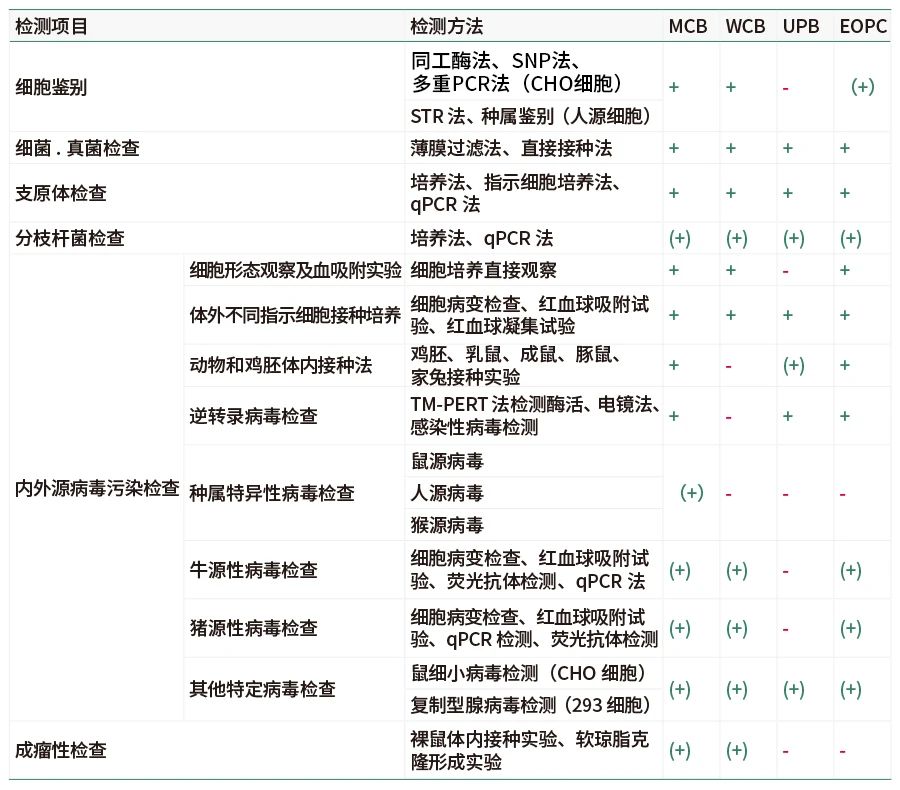
表注:“+”为必检项目,“-”为非强制检定项目。
(+)表示要根据细胞特性 、传代历史、培养过程等情况要求的检定项目。
加急快检服务
为了满足客户快速放行、快速掌握产品安全性的需求,义翘神州同时提供快速检测服务。
1 细胞库-热门检项加急检测
2 qPCR检项加急检测
部分案例展示
无菌检测
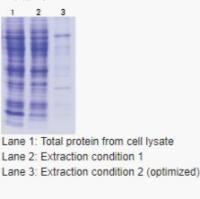
按照2020版《中国药典》三部通则1101无菌检查法以及 USP<71> STERILITY TESTS的要求进行,义翘神州可提供薄膜过滤法和直接接种法。无菌检查在GMP体系的B+A环境中进行,并且在检测过程中对环境进行持续监测。下图是采用薄膜过滤法的案例:

1-Staphylococcus aureus;2-枯草芽孢杆菌;3-黑曲霉;4-阴性;5-铜绿假单胞菌;6-生孢梭菌;7-白色念珠菌;8-大肠埃希菌
支原体检查——培养法
按照2020版《中国药典》中生物制品生产检定用动物细胞基质制备及质量控制、通则3301支原体检查法以及 USP<63> MYCOPLASMA TESTS的要求进行,义翘神州提供符合法规要求的支原体检查(培养法)。培养法检测的灵敏度高于中国药典要求,肺炎支原体达到10-9,口腔支原体达到10-5。

从左至右依次为10-7(3支),10-8(3支),10-9(3支),阴性对照。

从左至右依次为10-3(3支),10-4(3支),10-5(3支),阴性对照。