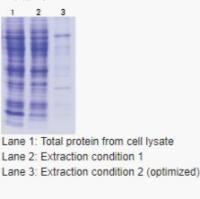
北京义翘神州科技股份有限公司(Sino Biological Inc.)品牌商
17 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0
- 0
- 2
- 2
品牌商
北京义翘神州科技股份有限公司(Sino Biological Inc.)
入驻年限:17 年
- 联系人:
客服部
- 所在地区:
北京
- 业务范围:
技术服务、试剂、抗体、细胞库 / 细胞培养、ELISA 试剂盒
- 经营模式:
生产厂商
推荐产品
公司新闻/正文
40年FDA首次批准?MASH/NASH新药上市?
889 人阅读发布时间:2024-03-25 10:08
非酒精性脂肪性肝炎(NASH),2023年6月正式更名为代谢功能障碍相关脂肪性肝炎(MASH),是一种代谢相关的综合征,严重者可发展为肝硬化和肝癌(HCC)。肝纤维化的阶段是疾病进展的决定因素。据统计对全球30%以上的人口有影响。Frost & Sullivan预计2030年,全球NASH患者将达到4.86亿。同时全球药物市场规模将达到322亿美元。
患者数量庞大而治疗药物稀缺,美国FDA近40年未批准NASH新药上市,因此Resmetirom的加速批准上市,在业界引起巨大震荡。“研发黑洞”、“难于上青天”是业内人士对NASH/MASH药物开发的普遍评价。在过去几十年已有上百款的NASH新药研发走向失败,但并未影响NASH赛道的火热,吉利德、诺华、默沙东等Top药企纷纷布局,百余种靶点正在研发或临床试验阶段。
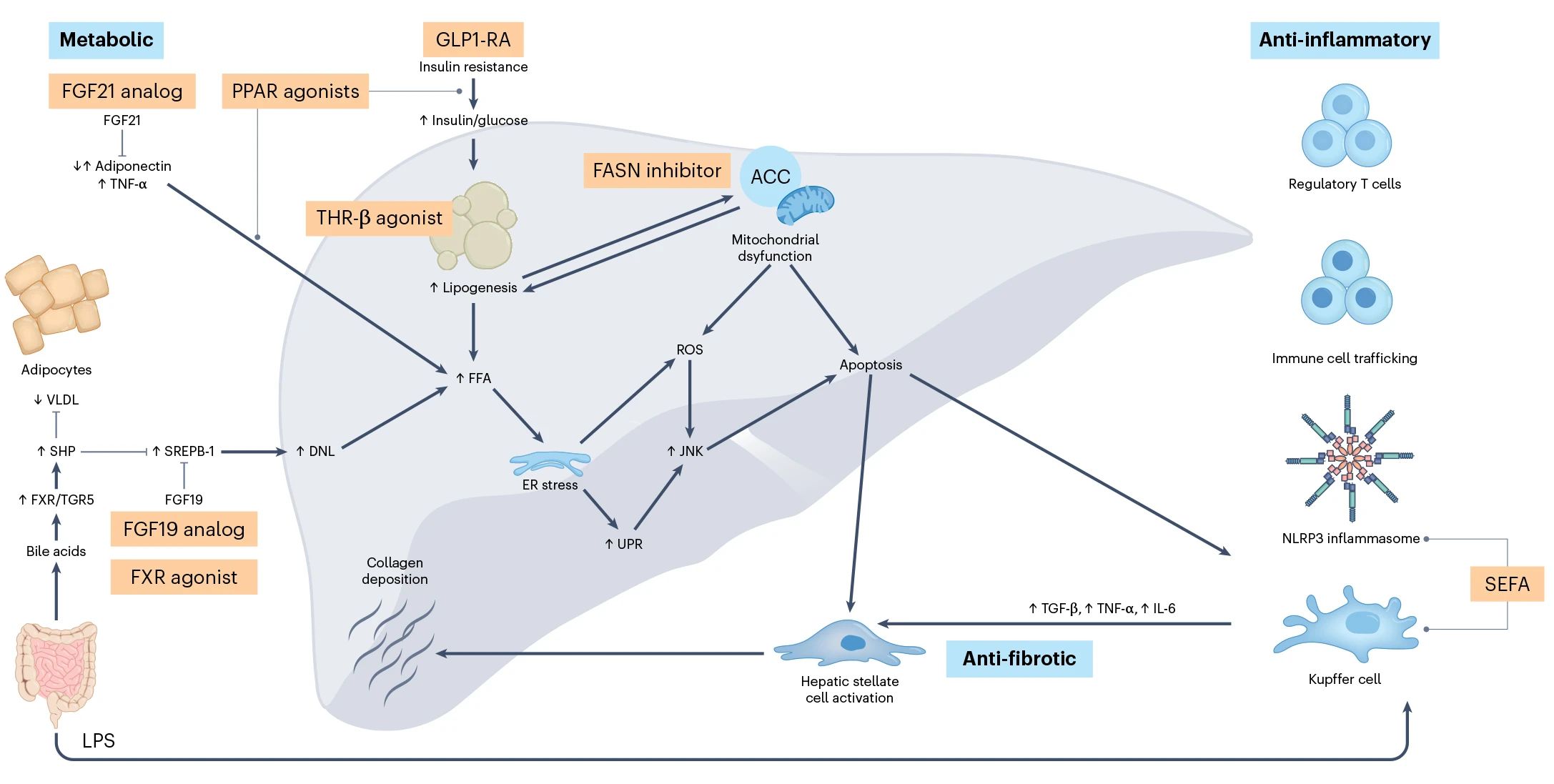
治疗NASH的靶点通路(源自参考文献:doi: 10.1038/s41591-023-02242-6)
据不完全统计,全球有超过500个NASH新药项目在研,且有超过200个项目处于临床开发阶段,覆盖THR-β、FGF21、PPAR和GLP-1等多种热门靶点。
FDA严格规定了NASH新药Ⅲ期临床试验的评审标准,需满足其中一项主要终点:1)患者脂肪肝炎改善且纤维化无进展,或者2)患者肝纤维化改善且脂肪肝炎无恶化。
Resmetirom不仅达到了NASH缓解和纤维化改善两个主要终点,关键次要终点与比安慰剂组相比,也出现明显降低。安全性方面,各试验组的严重不良事件发生率相近。
新药III期临床试验MAESTRO-NASH结果
如下数据均引用Madrigal Pharmaceuticals官网,供参考。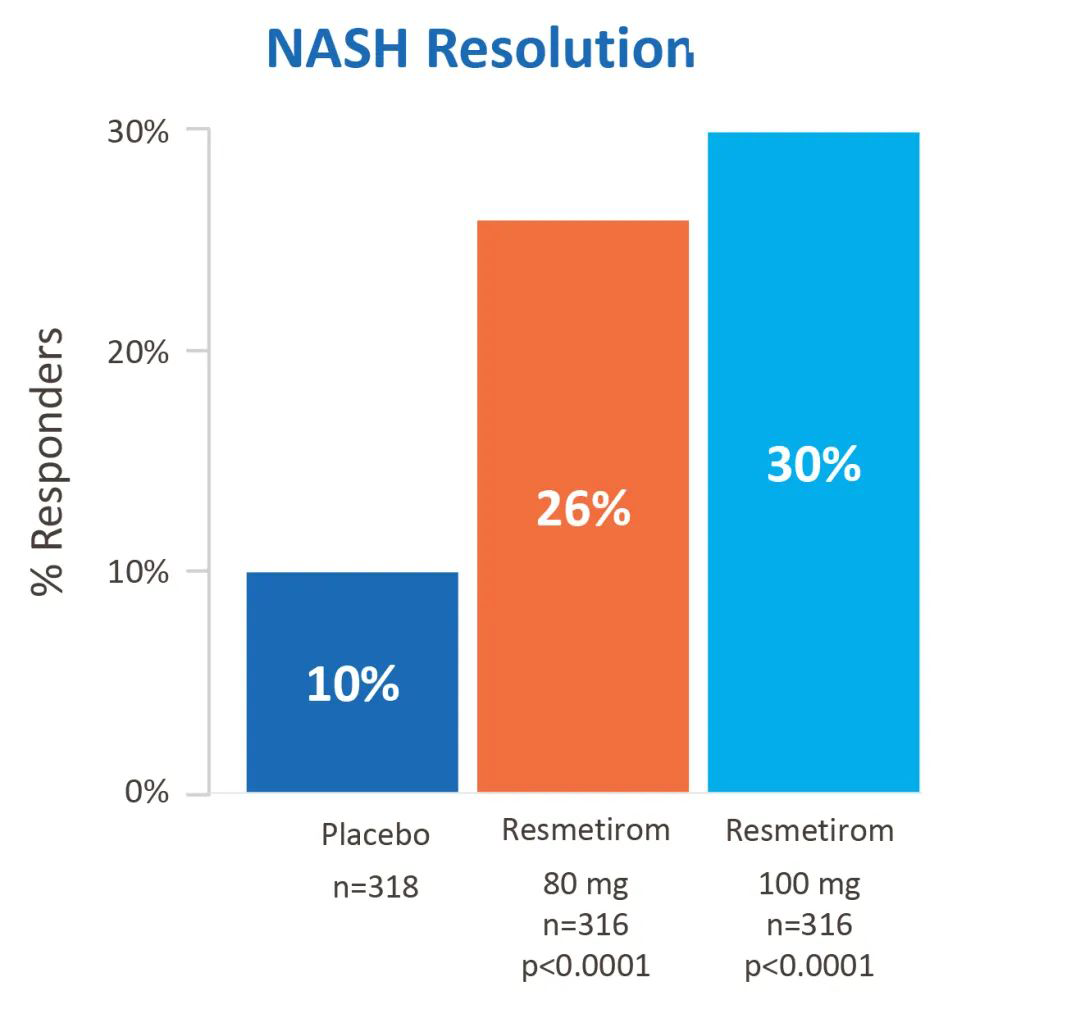
在NASH缓解且纤维化不恶化的主要终点上:接受治疗52周后,高剂量组、低剂量组和安慰剂组的发生率分别为30%、26%、10%,实现了NASH症状缓解。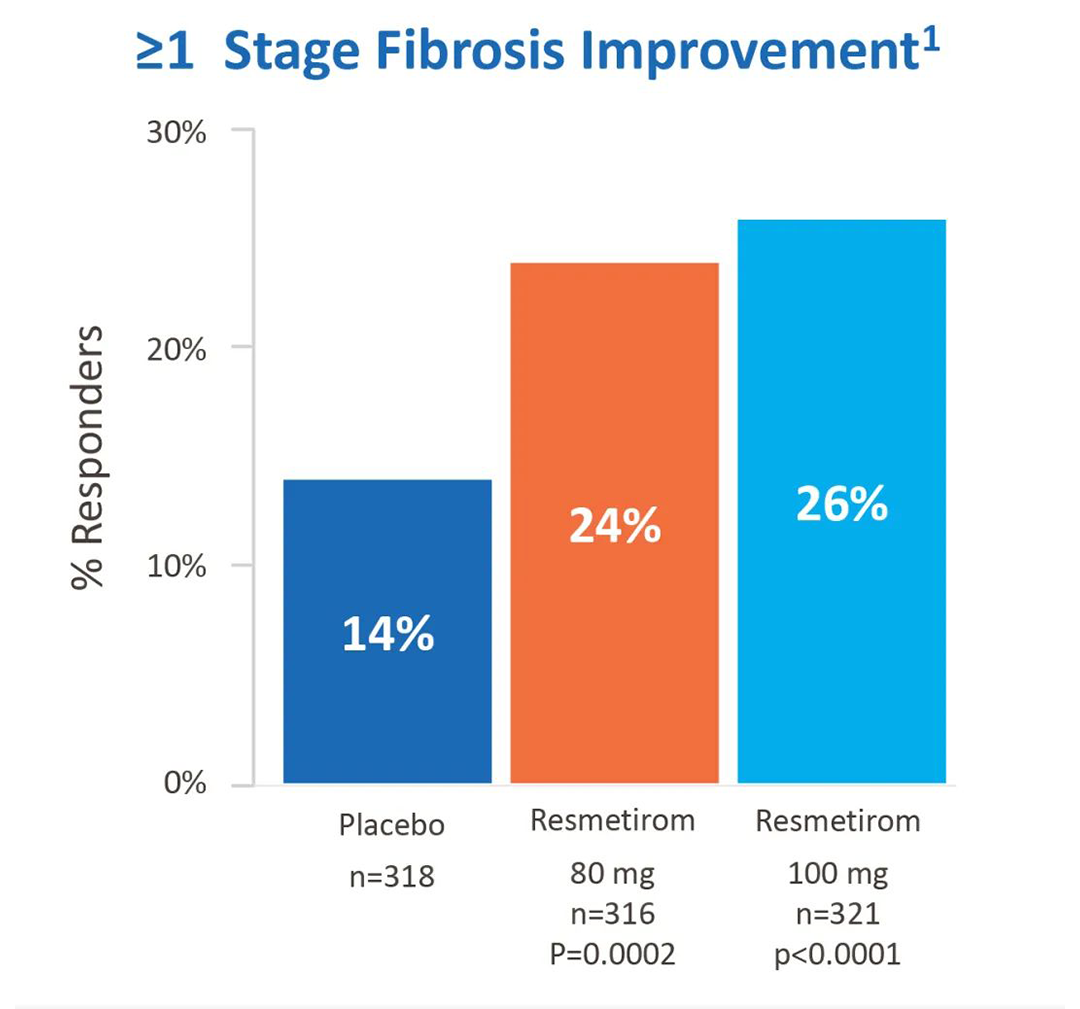 在纤维化改善≥1级且NASH不恶化的主要终点上:接受治疗52周后,高剂量组、低剂量组和安慰剂组的发生率分别为26%、24%、14%,实现了至少一个阶段的纤维化改善。
在纤维化改善≥1级且NASH不恶化的主要终点上:接受治疗52周后,高剂量组、低剂量组和安慰剂组的发生率分别为26%、24%、14%,实现了至少一个阶段的纤维化改善。
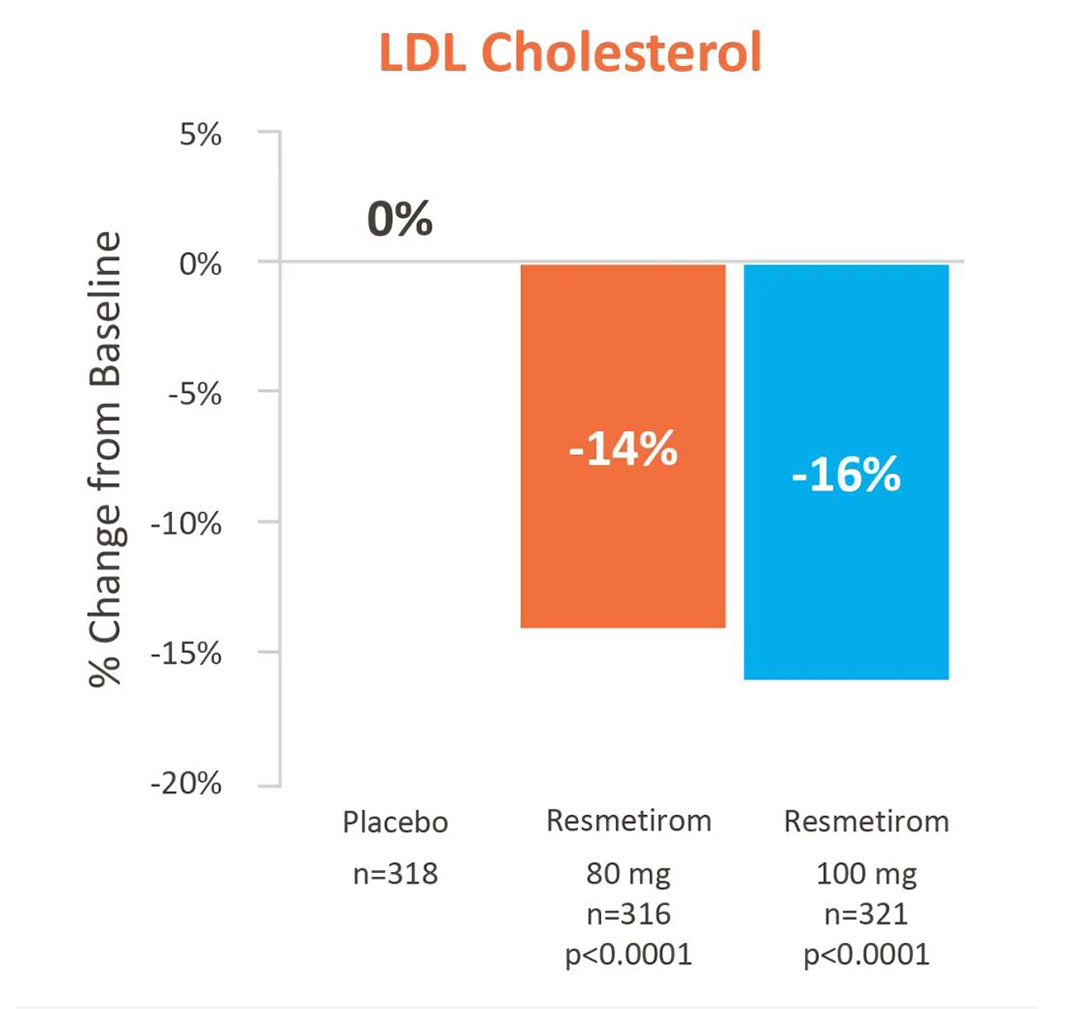 在次要终点低密度脂蛋白含量(LDL-C)降幅上,三个组分别为-16%、-12%、1%。
在次要终点低密度脂蛋白含量(LDL-C)降幅上,三个组分别为-16%、-12%、1%。
NASH临床Ⅱ、Ⅲ期主要靶点
图片源自参考文献:doi.org/10.2147/JEP.S265286
1 THR-β 同类药
据药融云数据库统计,靶向THRB的药物有17款。除了Resmetirom获批上市,还有4款处于Ⅱ期临床。
2023年5月,VK2809治疗NASH的IIb期研究达到主要终点(评估第12周患者肝脏脂肪含量的变化),最高有84.9%的患者实现肝脏脂肪含量至少降低30%,同时安全性良好,94%的副作用为轻度至中度。这意味着,VK2809可能展现出了比Resmetirom更佳的疗效。
2023年8月,拓臻生物也宣布了TERN-501治疗NASH的IIa期结果:3mg和6mg剂量组患者的MRI-PDFF呈剂量依赖性降低,其中6mg剂量组患者的肝脏脂肪含量降低了45%。同时,三个剂量组患者达到肝脏脂肪含量至少降低30%的比例均显著高于安慰剂组。
2 GLP-1R 靶点
GLP-1类似药不仅在减重和糖尿病方面表现出显著疗效,在NASH上的治疗潜力也可媲美Resmetirom。目前,诺和诺德司美格鲁肽已进入Ⅲ期临床,默沙东的GLP-1/GCGR双重激动剂Efinopegdutide获得FDA的快速通道认证,用于治疗NASH。
患者数量庞大而治疗药物稀缺,美国FDA近40年未批准NASH新药上市,因此Resmetirom的加速批准上市,在业界引起巨大震荡。“研发黑洞”、“难于上青天”是业内人士对NASH/MASH药物开发的普遍评价。在过去几十年已有上百款的NASH新药研发走向失败,但并未影响NASH赛道的火热,吉利德、诺华、默沙东等Top药企纷纷布局,百余种靶点正在研发或临床试验阶段。
01 NASH靶点概述
NASH药物的研发主要针对3种不同的致病过程:脂肪变性、炎症和纤维化。因此有3种不同的治疗路径:
- 靶向代谢靶点,改善对胰岛素的敏感性,抑制参与脂肪生成的酶,调节胆汁酸。
- 靶向炎症或细胞损伤靶点,抑制炎症细胞募集或阻断炎症信号传导。
- 直接靶向肝星状细胞的抗纤维化靶点,减少肝脏中胶原蛋白沉积。

治疗NASH的靶点通路(源自参考文献:doi: 10.1038/s41591-023-02242-6)
据不完全统计,全球有超过500个NASH新药项目在研,且有超过200个项目处于临床开发阶段,覆盖THR-β、FGF21、PPAR和GLP-1等多种热门靶点。
02 Resmetirom 领衔大戏开场
Resmetirom是甲状腺激素受体(THR)-β选择性激动剂。THR-β是维持正常肝功能的关键,包括调节线粒体活性(比如肝脏脂肪分解)以及控制正常、健康的线粒体水平,而在NASH患者中,肝脏中THR-β受体活性水平降低。Resmetirom具有高选择性,不会激活THR-α,不影响甲状腺激素通路中的其他信号,且在肝脏被特异性摄取,对骨骼或心脏无影响。FDA严格规定了NASH新药Ⅲ期临床试验的评审标准,需满足其中一项主要终点:1)患者脂肪肝炎改善且纤维化无进展,或者2)患者肝纤维化改善且脂肪肝炎无恶化。
Resmetirom不仅达到了NASH缓解和纤维化改善两个主要终点,关键次要终点与比安慰剂组相比,也出现明显降低。安全性方面,各试验组的严重不良事件发生率相近。
新药III期临床试验MAESTRO-NASH结果
如下数据均引用Madrigal Pharmaceuticals官网,供参考。

在NASH缓解且纤维化不恶化的主要终点上:接受治疗52周后,高剂量组、低剂量组和安慰剂组的发生率分别为30%、26%、10%,实现了NASH症状缓解。


03 更多NASH新药或将登场
NASH致病机理尚未完全探索清晰,全球药企从各种可能成药的方向进行研发。除THR-β外,还有FXR、FGF21、FGF19、GLP-1、PPAR、ASK1等靶点。NASH临床Ⅱ、Ⅲ期主要靶点

图片源自参考文献:doi.org/10.2147/JEP.S265286
1 THR-β 同类药
据药融云数据库统计,靶向THRB的药物有17款。除了Resmetirom获批上市,还有4款处于Ⅱ期临床。

2023年5月,VK2809治疗NASH的IIb期研究达到主要终点(评估第12周患者肝脏脂肪含量的变化),最高有84.9%的患者实现肝脏脂肪含量至少降低30%,同时安全性良好,94%的副作用为轻度至中度。这意味着,VK2809可能展现出了比Resmetirom更佳的疗效。

2023年8月,拓臻生物也宣布了TERN-501治疗NASH的IIa期结果:3mg和6mg剂量组患者的MRI-PDFF呈剂量依赖性降低,其中6mg剂量组患者的肝脏脂肪含量降低了45%。同时,三个剂量组患者达到肝脏脂肪含量至少降低30%的比例均显著高于安慰剂组。
2 GLP-1R 靶点
GLP-1类似药不仅在减重和糖尿病方面表现出显著疗效,在NASH上的治疗潜力也可媲美Resmetirom。目前,诺和诺德司美格鲁肽已进入Ⅲ期临床,默沙东的GLP-1/GCGR双重激动剂Efinopegdutide获得FDA的快速通道认证,用于治疗NASH。
| 药品名称 | 靶点 | 研发企业 | NASH主要进展 |
| 司美格鲁肽 | GLP-1R | 诺和诺德 | 2期临床结果积极:治疗72周后显菩改善NASH症状,未导致肝纤维化的恶化 |
| Efinopegdutide | GLP-1R/GCGR | 默沙东 | 2a期临床试验结果:治疗24周后肝脏脂肪水平降低72.7%,活性对照组仅为42.39%。 |
| tirzepatide | GLP-1R/GIPR | 礼来 | 2期临床结果积极:73.9%达到试验的主要终点,接受治疗1年后NASH症状消除且肝纤维化没有恶化 |
| survodutide | GLP-1R/GCGR | Boehringer lngelheim / Zealand Pharma | 2期临床试验结果:83%患者获得统计显著的症状改善 |
3 FGF21 靶点
FGF21通过β-Klotho受体招募到细胞质膜表面,然后与FGF21R复合物结合,激活ERK、PI3K/AKT和JAK/STAT通路。FGF21在肝脏脂质代谢中发挥重要作用。在动物实验中给予FGF21可减轻肝脏脂肪变性。研究发现FGF21表达增加能够抑制NASH患者的炎症反应,并协同缓解肥胖和胰岛素抵抗。
Efruxifermin的2b临床结果
1. 所有接受治疗的患者中,48%的纤维化程度至少得到一阶段的改善,且NASH未恶化。
2. 在研究开始时患有2期或3期纤维化的接受治疗的患者中,有50%在研究结束时实现了至少两阶段的纤维化改善。
3. 接受治疗的患者中有48%的NASH得到缓解,且纤维化没有恶化。
Efruxifermin的2b临床结果
1. 所有接受治疗的患者中,48%的纤维化程度至少得到一阶段的改善,且NASH未恶化。
2. 在研究开始时患有2期或3期纤维化的接受治疗的患者中,有50%在研究结束时实现了至少两阶段的纤维化改善。
3. 接受治疗的患者中有48%的NASH得到缓解,且纤维化没有恶化。
04 NASH新药研发的国产力量
面对数百亿美元的巨大市场,国产药企同样不会拱手让人。目前,中国生物制药、歌礼制药、众生药业、海思科、石药集团等已经跻身前列。
中国生物制药布局全面,靶点涵盖FXR、PPAR、FGF-21、GLP-1以及THR-β等。从Inventia引入的PPAR激动剂Lanifibranor是国内进入3期临床的NASH口服药。
歌礼制药主要布局FASN抑制剂、THR-β激动剂,相关药物已进入2期临床。其他还有FXR激动剂、THRβ/FXR双靶点药物。ASC41是目前国内进度最快的THR-β激动剂,治疗NASH患者52周Ⅱ期试验已取得积极期中结果:用药12周后,患者肝脏脂肪相对降幅平均值高达68.2%,且显示出良好的安全性和耐受性。
众生药业布局多款管线,其中PDE抑制剂ZSP1601是国内获批临床用于治疗NASH的创新药,目前正在开展Ⅱ期临床试验且结果积极。2a期数据表明,ZSP1601可以明显改善肝生化功能,治疗组患者肝脂肪含量较基线下降25.5%,优于安慰剂组的12.8%。
NASH 新药研发小结
NAFLD/NASH是一种复杂的、由多种致病因素引起的、严重的慢性肝脏疾病,患者需长期用药。40年来FDA仅批准一款药物用于治疗NASH,远远不能满足巨大的临床需求。受到Resmetirom上市刺激,全球的研发热度必然会更高。
作为重组技术的全球引航员,义翘神州提供NASH相关的高品质药物靶点蛋白及抗体产品,以支持NASH药物发现和靶点作用机制研究,推动NASH及其并发症(如糖尿病)的创新疗法开发。
义翘神州NASH靶点产品(部分)
中国生物制药布局全面,靶点涵盖FXR、PPAR、FGF-21、GLP-1以及THR-β等。从Inventia引入的PPAR激动剂Lanifibranor是国内进入3期临床的NASH口服药。
歌礼制药主要布局FASN抑制剂、THR-β激动剂,相关药物已进入2期临床。其他还有FXR激动剂、THRβ/FXR双靶点药物。ASC41是目前国内进度最快的THR-β激动剂,治疗NASH患者52周Ⅱ期试验已取得积极期中结果:用药12周后,患者肝脏脂肪相对降幅平均值高达68.2%,且显示出良好的安全性和耐受性。
众生药业布局多款管线,其中PDE抑制剂ZSP1601是国内获批临床用于治疗NASH的创新药,目前正在开展Ⅱ期临床试验且结果积极。2a期数据表明,ZSP1601可以明显改善肝生化功能,治疗组患者肝脂肪含量较基线下降25.5%,优于安慰剂组的12.8%。
NASH 新药研发小结
NAFLD/NASH是一种复杂的、由多种致病因素引起的、严重的慢性肝脏疾病,患者需长期用药。40年来FDA仅批准一款药物用于治疗NASH,远远不能满足巨大的临床需求。受到Resmetirom上市刺激,全球的研发热度必然会更高。
作为重组技术的全球引航员,义翘神州提供NASH相关的高品质药物靶点蛋白及抗体产品,以支持NASH药物发现和靶点作用机制研究,推动NASH及其并发症(如糖尿病)的创新疗法开发。
义翘神州NASH靶点产品(部分)
| 靶点 | 货号 | 种属 | 纯度/标签/其它 |
|---|---|---|---|
| THR-β | 15737-H07E | Human | ≥95%、His、HPLC |
| GLP-1R | 13944-H49H-B | Human | ≥ 95%、His & AVI、HPLC |
| GLP-1R | 13944-H02H | Human | ≥959%、hFc、HPLC |
| FASN | 30113-H07E | Human | ≥ 95%、His |
| FASN | 57840-M07E | Mouse | ≥95%、His |
| FGF19 | 12226-HNAE | Human | ≥95%、HPLC |
| FGF21 | 10911-H07E | Human | >95%、His |
| FGF21 | 50421-M08H | Mouse | >85%、His |
| FGF21 | 5A7643-M08H | Mouse | > 95%、His |
| GCGR | 30122-H08H | Human | ≥ 95%、His、HPLC |
| GIPR | 18774-H49H-B | Human | 95%、His & AVI、HPLC |
| PPARA | 12080-H07E | Hamster | >95%、His |
【参考文献】
1. Madrigal Pharmaceuticals Announces FDA Approval of Rezdiffra™ (resmetirom) for the Treatment of Patients with Noncirrhotic Nonalcoholic Steatohepatitis (NASH) with Moderate to Advanced Liver Fibrosis. Retrieved March 14, 2024 from https ://ir.madrigalpharma.com/news-releases/news-release-details/madrigal-pharmaceuticals-announces-fda-approval-rezdiffratm
2. Harrison et al., (2024). A Phase 3, Randomized, Controlled Trial of Resmetirom in NASH with Liver Fibrosis. NEJM, DOI: 10.1056/NEJMoa2309000
3. Stephen et al., Challenges and opportunities in NASH drug development. Nature Medicine, https://doi.org/10.1038/s41591-023-02242-6
4. Huisman et al, Experimental and Investigational Targeted Therapies for the Management of Fibrosis in NASH: An Update. Journal of Experimental Pharmacology, http://doi.org/10.2147/JEP.S265286
5. 各公司官网或公开数据库
6. Madrigal Pharmaceuticals Announces Publication of the Phase 3 MAESTRO-NASH Trial of Resmetirom in the New England Journal of Medicine. Retrieved February 8, 2024, from https://www.globenewswire.com/news-release/2024/02/08/2825978/0/en/Madrigal-Pharmaceuticals-Announces-Publication-of-the-Phase-3-MAESTRO-NASH-Trial-of-Resmetirom-in-the-New-England-Journal-of-Medicine.html
7. Loomba R, et al. Controlled Trial of the FGF21 Analogue Pegozafermin in NASH. N Engl J Med. 2023doi: 10.1056/NEJMoa2304286.
8. 89bio Reaches Alignment with the FDA and EMA on Phase 3 Program for Pegozafermin in Nonalcoholic Steatohepatitis (NASH); Program Initiation Planned in the First Half of 2024. Retrieved March 1, 2024 from https://ir.89bio.com/news-releases/news-release-details/89bio-reaches-alignment-fda-and-ema-phase-3-program-pegozafermin
9. Sagimet Biosciences Announces Positive Topline Results from Phase 2b FASCINATE-2 Clinical Trial of Denifanstat in Biopsy-Confirmed F2/F3 NASH. Retrieved March 1, 2024 from https://ir.sagimet.com/news-releases/news-release-details/sagimet-biosciences-announces-positive-topline-results-phase-2b
2. Harrison et al., (2024). A Phase 3, Randomized, Controlled Trial of Resmetirom in NASH with Liver Fibrosis. NEJM, DOI: 10.1056/NEJMoa2309000
3. Stephen et al., Challenges and opportunities in NASH drug development. Nature Medicine, https://doi.org/10.1038/s41591-023-02242-6
4. Huisman et al, Experimental and Investigational Targeted Therapies for the Management of Fibrosis in NASH: An Update. Journal of Experimental Pharmacology, http://doi.org/10.2147/JEP.S265286
5. 各公司官网或公开数据库
6. Madrigal Pharmaceuticals Announces Publication of the Phase 3 MAESTRO-NASH Trial of Resmetirom in the New England Journal of Medicine. Retrieved February 8, 2024, from https://www.globenewswire.com/news-release/2024/02/08/2825978/0/en/Madrigal-Pharmaceuticals-Announces-Publication-of-the-Phase-3-MAESTRO-NASH-Trial-of-Resmetirom-in-the-New-England-Journal-of-Medicine.html
7. Loomba R, et al. Controlled Trial of the FGF21 Analogue Pegozafermin in NASH. N Engl J Med. 2023doi: 10.1056/NEJMoa2304286.
8. 89bio Reaches Alignment with the FDA and EMA on Phase 3 Program for Pegozafermin in Nonalcoholic Steatohepatitis (NASH); Program Initiation Planned in the First Half of 2024. Retrieved March 1, 2024 from https://ir.89bio.com/news-releases/news-release-details/89bio-reaches-alignment-fda-and-ema-phase-3-program-pegozafermin
9. Sagimet Biosciences Announces Positive Topline Results from Phase 2b FASCINATE-2 Clinical Trial of Denifanstat in Biopsy-Confirmed F2/F3 NASH. Retrieved March 1, 2024 from https://ir.sagimet.com/news-releases/news-release-details/sagimet-biosciences-announces-positive-topline-results-phase-2b