北京义翘神州科技股份有限公司(Sino Biological Inc.)品牌商
17 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0
- 0
- 2
- 2
品牌商
北京义翘神州科技股份有限公司(Sino Biological Inc.)
入驻年限:17 年
- 联系人:
客服部
- 所在地区:
北京
- 业务范围:
技术服务、试剂、抗体、细胞库 / 细胞培养、ELISA 试剂盒
- 经营模式:
生产厂商
推荐产品
公司新闻/正文
JAK-STAT信号通路全面梳理:成员、调控机制、靶向治疗……
825 人阅读发布时间:2025-03-07 15:20
先讲个故事
2024年11月5日,中国科学院在上海举办“纪念JAK-STAT 30周年庆典和科学论坛”。四川大学华西医院傅新元教授在开幕致辞中提到:
JAK-STAT信号通路是科学家首次发现的从细胞膜受体到细胞核内基因表达的通路。迄今与此通路有关的科学论文已超过10万余篇,对生命科学和医学的发展产生了深远影响。针对此通路的第一代靶点JAK的药物研发直接产生了12个以上FDA等机构批准的创新药,全球累计销售额已达300亿美元以上。三十多年来,JAK-STAT通路的发现和研究,对关键生物学过程和多种相关疾病具有重大意义。
傅新元教授在JAK-STAT通路的发现和转化过程中,做出了开创性贡献。他在研究干扰素信号通路时,发现p84/p91和p113基因编码的蛋白存在SH2结构域,并大胆猜想SH2结构域将细胞外的干扰素信号从被激活的受体传导进入细胞核。1992年,傅新元以作者的身份将这项新发现发表在Cell杂志上。
令人遗憾的是,傅新元和其导师James Darnell都在文章中明确指出存在一个酪氨酸激酶是ISGF-3进行磷酸化的关键激酶,但是他们没有确定这个蛋白激酶。而令人感到惊奇的是,这一关键激酶的鉴定文章,恰好就与傅新元的论文发表在同一期Cell杂志上。

傅新元还提出了“Transcriptional Activator and Signal Transducer”的概念,Darnell将其演化为“Signal Transducer and Activator of Transcription”,即STAT。p84/p91和p113基因编码的蛋白被正式命名为STAT1和STAT2。
1993年,JAK-STAT信号通路被Science杂志评为世界十大重大科学成就之一,从此一个全新的领域诞生了。
拼图一:JAK-STAT信号“全家桶”
JAK-STAT通路始于干扰素(IFN)的研究。上世纪九十年代,JamesDarnell团队发现ISGF-3转录激活因子,能够刺激干扰素-α,后来确认ISGF-3包含STAT1、STAT2和IRF9,即SATA蛋白家族。几乎同时,Wilks团队鉴定出具有特定激酶和假激酶结构域的酪氨酸激酶,即JAK激酶家族。1992年,Velazquez等人发现TYK2是IFN-α/β信号通路中不可或缺的蛋白,标志着JAKs与STATs之间的联系被发现。Müller等人进一步证实JAK磷酸化STAT实现信号转导。随后,对JAK-STAT通路的研究不断拓展深入。
目前已证实,JAK-STAT通路是一种进化上保守的跨膜信号转导,负责将细胞外的化学信号转入细胞内部,进而传递到细胞核内,完成调控基因转录水平的目的。JAK-STAT通路“全家福”包括50多个配体(如干扰素、白介素、生长因子等)、30多个受体、4个Janus激酶JAK以及6个信号转导和转录激活因子STAT蛋白。
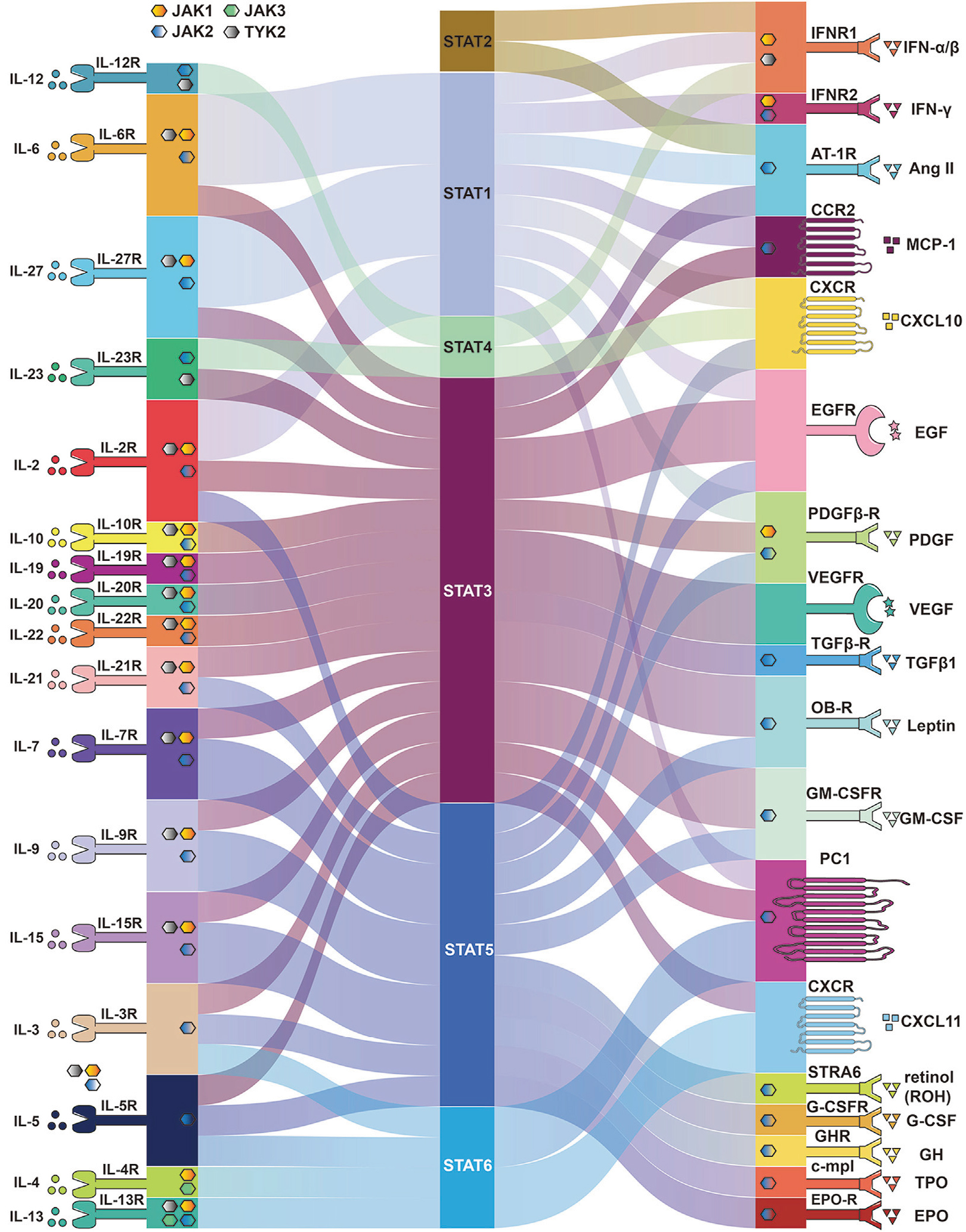
激活JAK-STAT信号通路的细胞因子及其它蛋白受体
(源自文献:doi: 10.3389/fbioe.2023.1110765)
拼图二:破解结构迷雾,方得JAK真面目
Janus激酶(JAK)在此信号通路中起着承上启下的关键衔接作用。JAK家族共有四个成员:JAK1、JAK2、JAK3和TYK2,与细胞因子受体中的两个不同保守结构片段Box1和Box2相互作用。JAKs均由7个JAK同源结构域JH构成,包括FERM、SH2、假激酶Pseudo-kinase及激酶4种结构域。
前期研究缺乏激活状态下的全长JAK蛋白结构信息。直到2021年,科学家才获得与细胞因子受体细胞内结构域结合的全长JAK13.6 Å 分辨率的冷冻电镜结构。全长结构有助于揭示受体胞外域二聚化使胞内JAK单体进入合适位置和完成激活的机制,以及阐述JAK基因突变导致功能异常的结构基础。全长结构揭开了假激酶结构域的调控之谜,为开发变构抑制剂提供全新方向,如针对JAK2 V617F突变的变构药物,有望解决传统激酶抑制剂的耐药性问题。
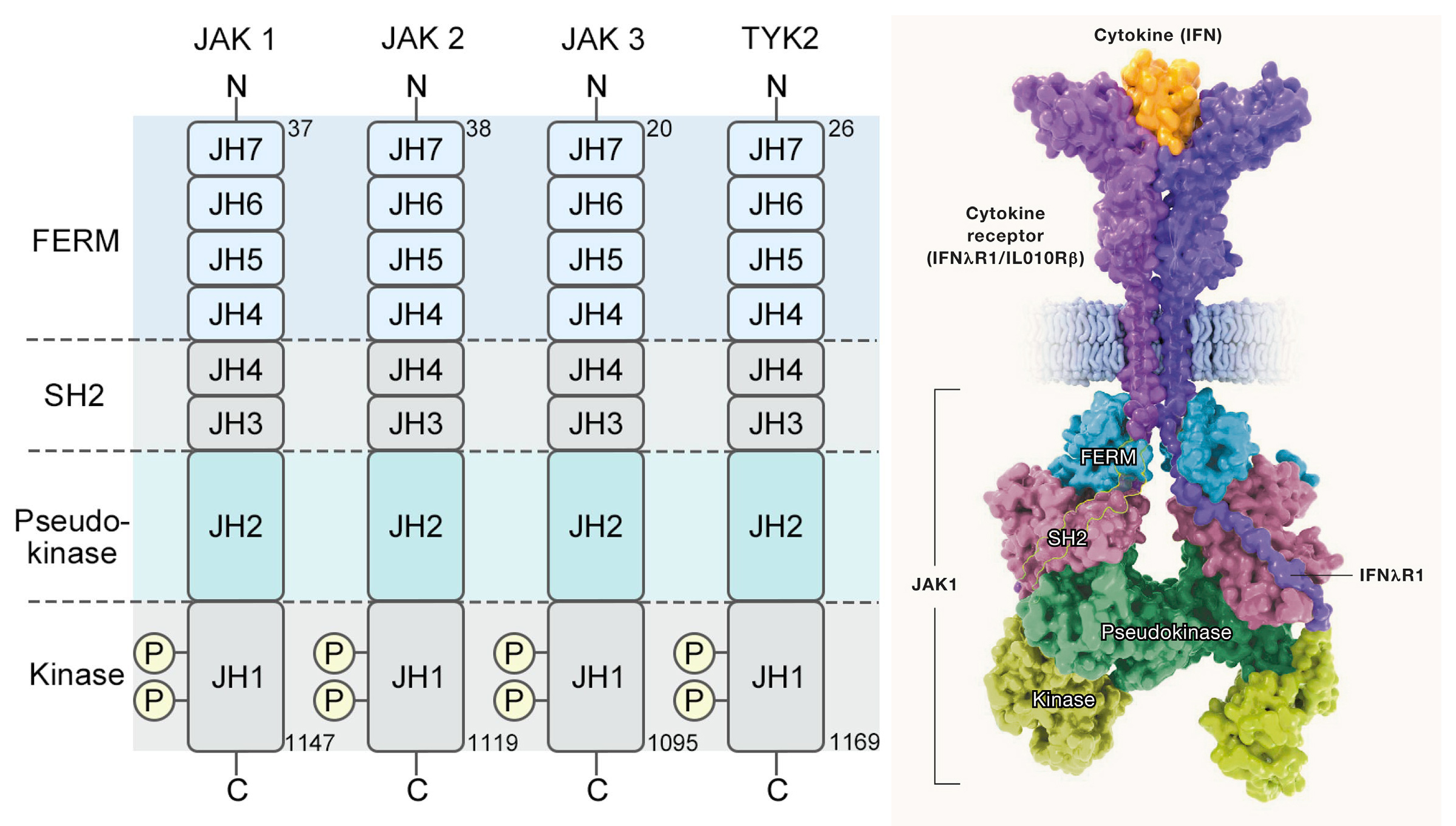
JAK激酶结构
(源自文献:doi: 10.1186/s12943-023-01929-1, doi: 10.1016/j.cell.2022.09.023)
拼图三:经典JAK-STAT通路激活与负调控
经典JAK-STAT信号通路的激活主要包括以下五步:
1,细胞因子与受体结合,引发受体二聚化;
2,JAK激酶被激活,对受体酪氨酸残基进行磷酸化,形成STAT停靠位点;
3,在停靠位点,STAT被JAK磷酸化,并结合到磷酸化的受体上;
4,进一步磷酸化后STSA与受体解离,通过SH2结构域-磷酸酪氨酸相互作用形成同源二聚体或异源二聚体;
5,STAT二聚体进入细胞核,并结合到特定的DNA序列,调控下游基因的转录,引发细胞的生物学效应,如炎症反应、细胞增殖、免疫调控等。
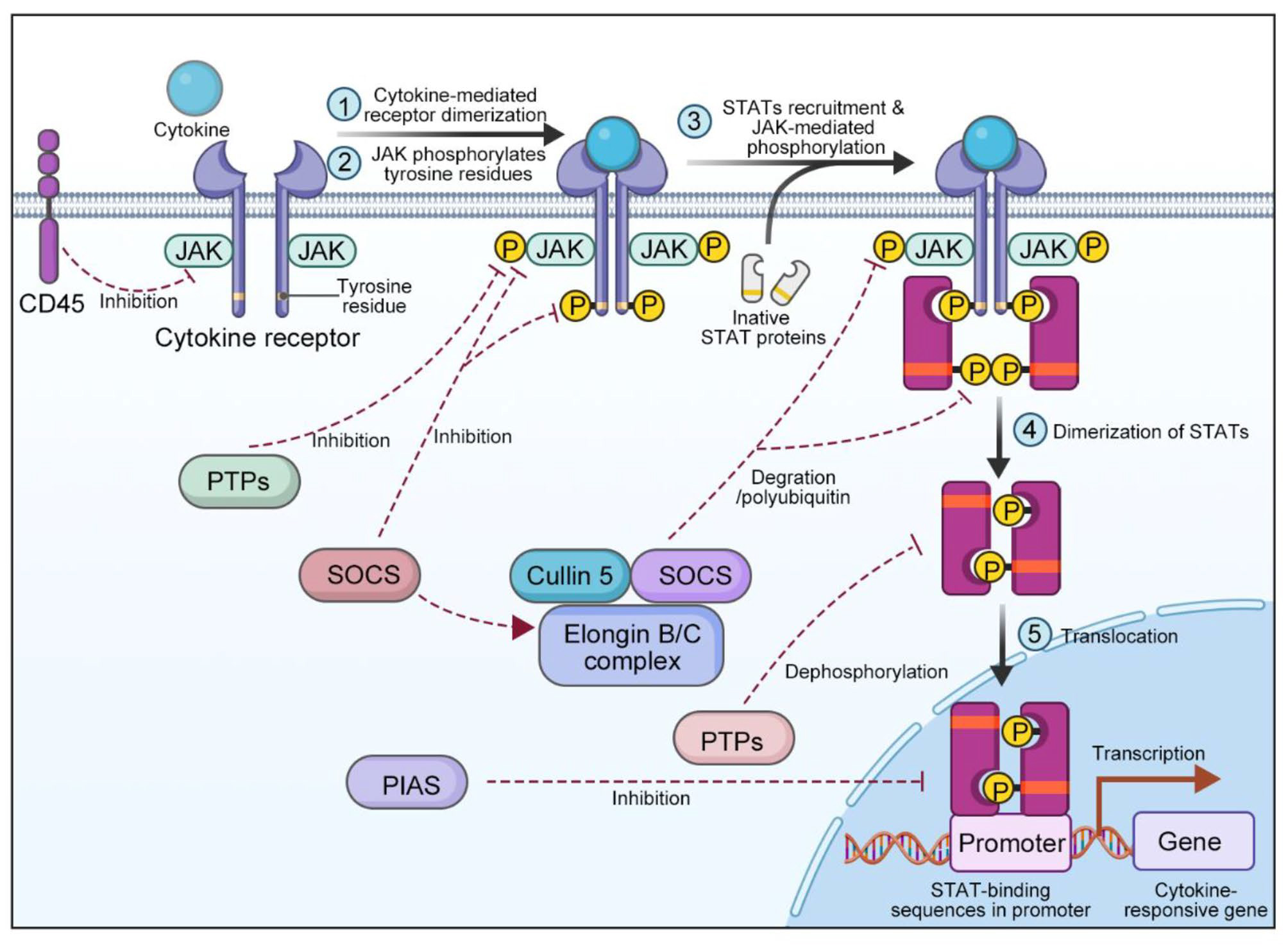
JAK-STAT通路激活与负调控机制
(源自文献:doi: 10.1186/s12943-023-01929-1)
JAK-STAT信号通路的激活受到许多调节因子抑制,主要有:细胞因子信号传导抑制剂CIS/SOCS、激活STAT的蛋白抑制剂PIAS及蛋白酪氨酸磷酸酶PTP。
JAK-STAT通路负调控主要蛋白家族:
CIS/SOCS家族是JAK-STAT通路主要的负调控蛋白,包括CIS和SOCS1-7。这些蛋白在STAT二聚体进入细胞核后被诱导表达,通过多种方式抑制JAK-STAT通路。比如SOCS蛋白通过其SH2机构域和受体上的磷酸酪氨酸残基结合,阻止STAT蛋白的招募。SOCS还可直接与JAK或其受体结合,抑制JAK的激酶活性。SOCS蛋白的C端SOCS盒结构域能够与延伸蛋白B/C复合物相互作用,并与cullin5结合,形成E3泛素连接酶复合物,阻断信号转导。
PIAS家族主要与STAT二聚体相互作用,抑制STAT与DNA结合,从而阻断JAK-STAT信号转导。PIAS家族成员由PIAS1-4及4种剪接变体构成。PIAS1和PIAS3通过阻断STAT与DNA的结合活性来阻断信号转导。PIAS家族作为SUMO E3连接酶,调控STAT蛋白的活性和稳定性。PIAS蛋白还通过募集共抑制分子和组蛋白脱乙酰酶、螯合转录因子等机制阻止STAT与DNA结合。PIAS蛋白缺失导致JAK-STAT信号活性升高,促进血液肿瘤的形成。
PTPs通过其SH结构域与信号分子、活化的受体以及JAK激酶结合,促使底物去磷酸化,从而抑制JAK/STAT信号传导。如SHP-1可与IFN-α受体结合,SHP-2负调节IFN对STAT过度激活的细胞毒性作用,促进细胞生长,但其在JAK-STAT信号通路中的具体作用尚待深入研究。
拼图四:多通路串联调控生命活动
JAK-STAT信号通路各成员间与其他信号通路的相互串扰更加复杂,发生在多个层面,构织成一个“麻团”。这些串扰涉及受体、JAK、STAT和基因转录等多种分子,相关通路有TGF-β、MAPK、Notch、PI3K/AKT/mTOR、NF-κB等。这些信号通路对调控多能性、细胞分化、免疫反应、血管生成及肿瘤发展等至关重要。
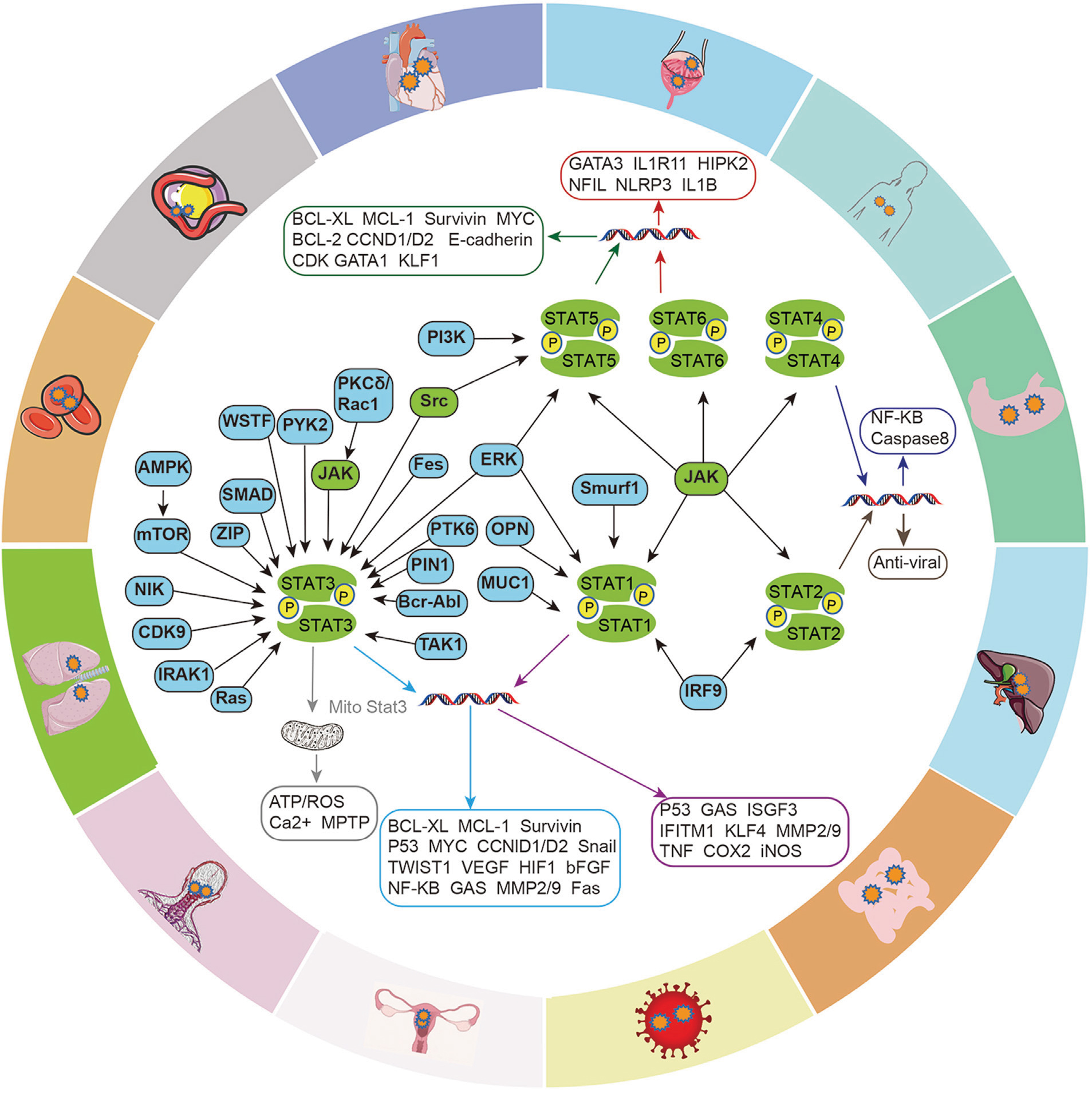
不同信号蛋白激活多种JAK-STAT相关通路
(源自文献:doi: 10.3389/fbioe.2023.1110765)
拼图五:JAK-STAT通路与免疫调节
多种细胞因子与JAK-STAT信号通路相互作用,在免疫细胞分化、发育中发挥重要作用。干扰素IFN和白介素IL-12通过STAT1和STAT4驱动T-bet基因表达,调控Th1细胞分化。IL-4通过STAT6上调GATA3基因表达,进而激活Th2细胞分化。IL-6和TGF在Th17细胞分化中发挥重要作用。
不同细胞因子刺激JAK-STAT信号通路在免疫调节过程中发挥复杂的功能。如干扰素触发STAT信号,识别癌细胞,IL-6-STAT3信号触发免疫逃逸。JAK-STAT信号通路通过响应IL-2、IL-15、IFN等,诱导NK细胞活化,驱动抗肿瘤免疫监视。JAK-STAT信号通路与多种自身免疫性疾病的发病机制相关,如IL-6诱导STAT3磷酸化,上调Th17细胞的分化,从而促进类风湿性关节炎的发展。
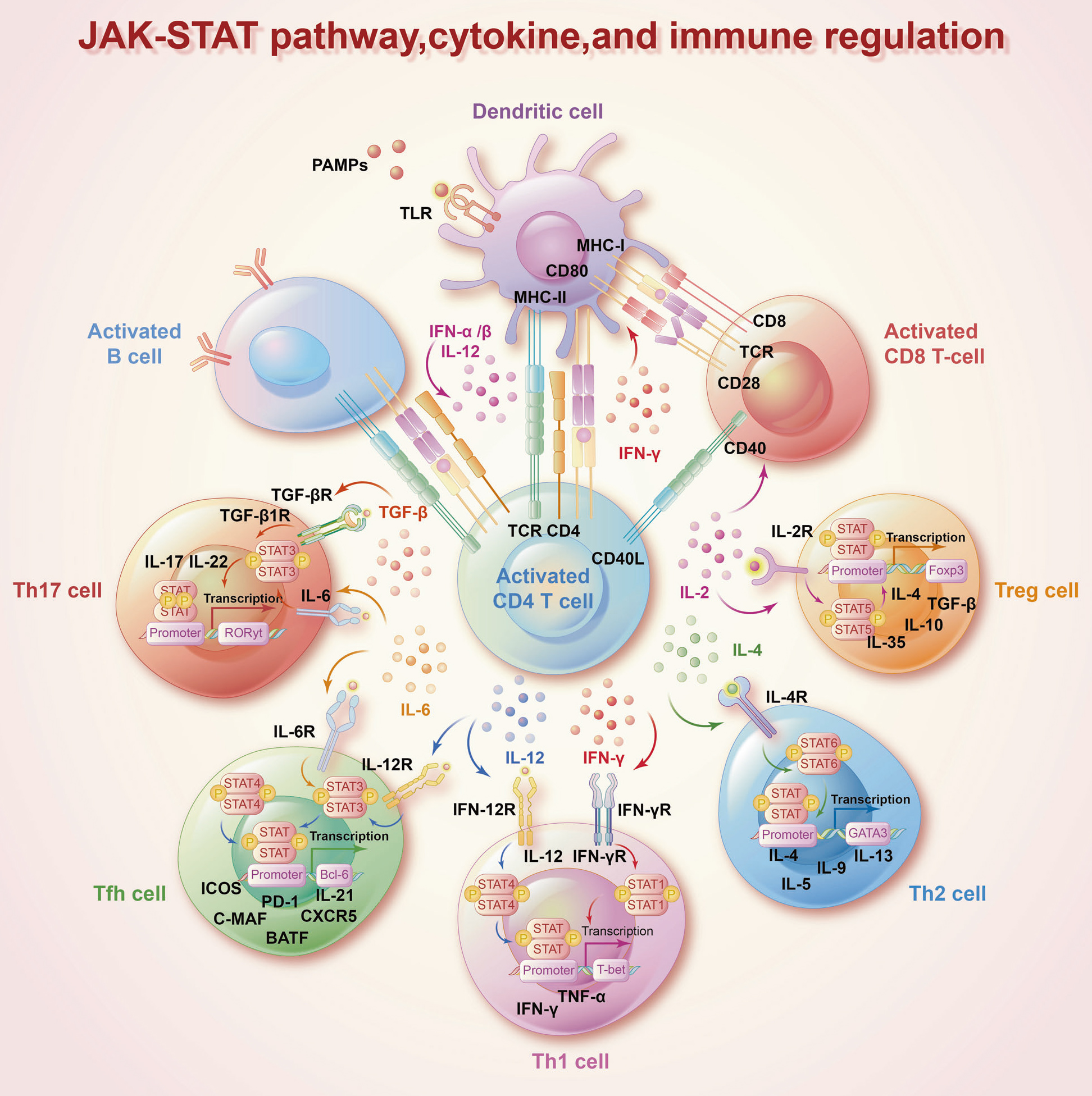
JAK-STAT信号通路与免疫调节
(源自文献:doi: 10.1038/s41392-023-01468-7)
拼图六:靶向治疗的“三头六臂”
JAK-STAT信号通路已成为癌症和自身免疫性疾病药物开发的重要靶点。在癌症治疗中,靶向JAK-STAT通路,可以抑制肿瘤生长、转移、血管生成,在自身免疫性疾病中,它们可以减轻炎症和免疫细胞的异常活化。根据其影响信号传导过程的作用机制,主要有细胞因子或受体抗体、JAK抑制剂、STAT抑制剂等3类,其它如多肽抑制剂、寡核苷酸、小干扰RNA等。
如前文所述,大多数细胞因子参与了JAK-STAT信号通路,因此靶向特定细胞因子或其受体,阻断其与JAK-STAT通路的相互作用,抑制相关信号传导,已用于多种疾病的治疗干预措施。种类有工程重组细胞因子、细胞因子或受体抗体,目前有一种新型药物正在开发中,可提高细胞因子“有效载荷”,即细胞因子-抗体融合物。
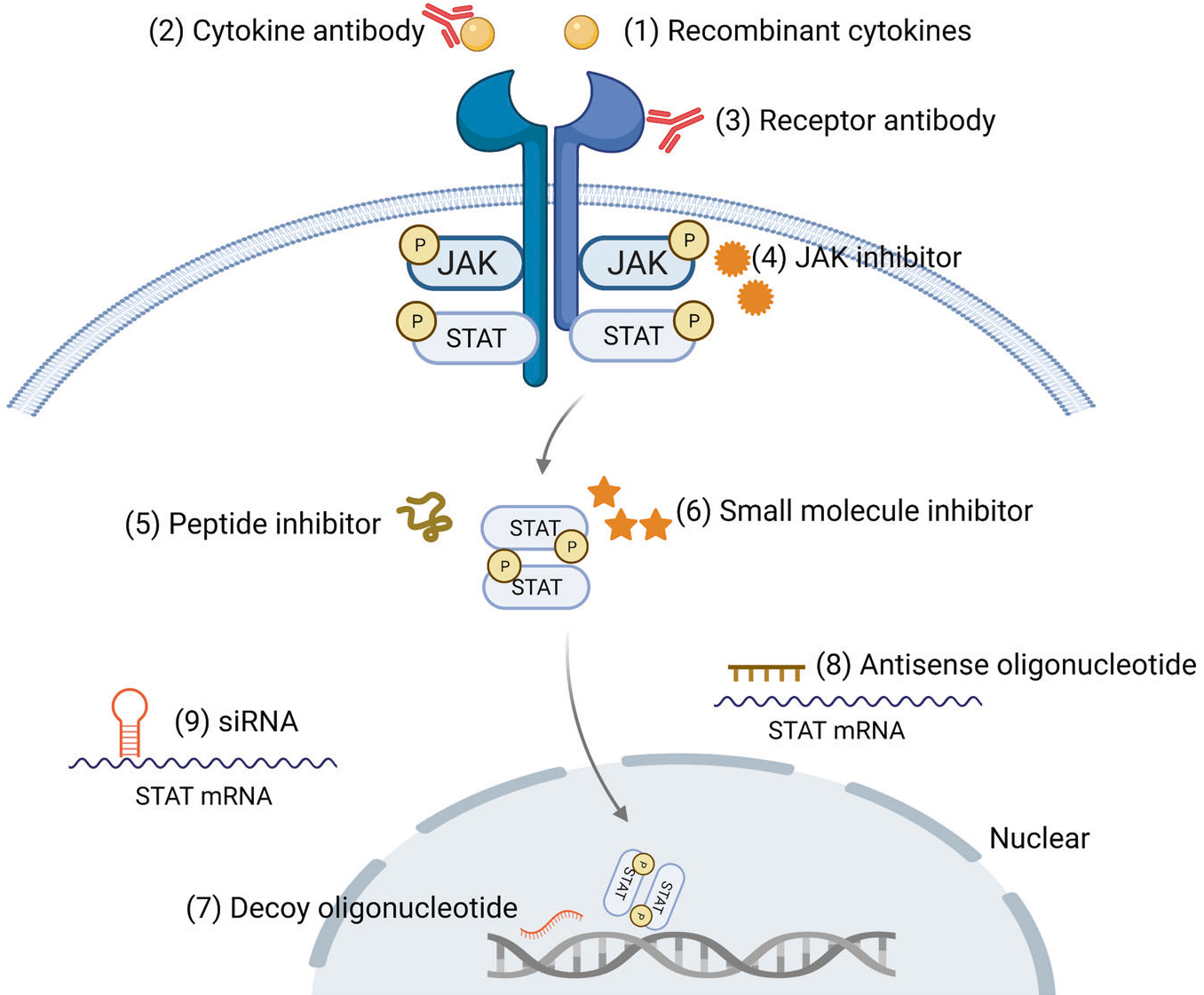
靶向JAK-STAT通路治疗策略
(源自文献:doi: 10.1038/s41392-021-00791-1)
拼图七:潜力无限的JAK抑制剂
JAK抑制剂是这类药物中最为瞩目的。目前,全球已有10多款JAK小分子抑制剂获批上市,用于治疗骨髓增生性疾病、移植抗宿主病、类风湿性关节炎、银屑病关节炎、炎症性肠病等。JAK抑制剂主要通过两种机制达到治疗效果。一是产生免疫抑制,减少由JAK-STAT通路介导的血清中促炎细胞因子的表达;二是识别并抑制JAK突变体的表达。
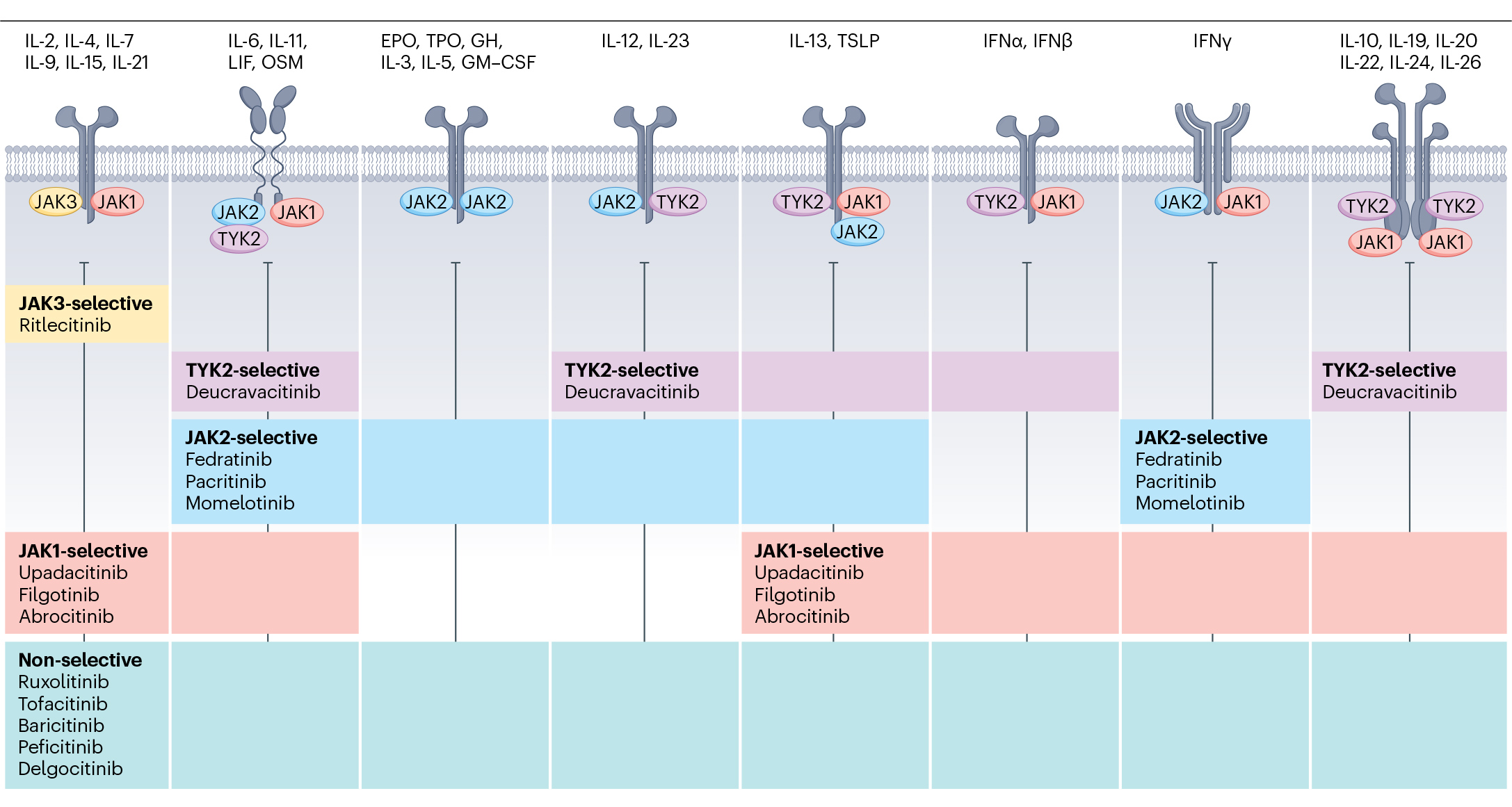
获批上市的JAK抑制剂功能
(源自文献:doi: 10.1038/s41584-024-01153-1)
JAK抑制剂存在相似的不良反应,如感染、血脂异常、血细胞减少等。研究发现,不良反应与特定细胞因子相关。选择性JAK抑制剂的开发,干扰较少细胞因子的功能,能够增加特异性,减少不良反应。为减少不良反应以及提高JAK抑制剂的疗效,研究人员正在开发选择性更高的JAK抑制剂。未来可能会开发出根据疾病或疾病的某一阶段及相关的细胞因子,精准的定制治疗和联合治疗。
义翘神州精选试剂
义翘神州全资子公司SignalChem Biotech提供涵盖高活性JAK激酶、STAT蛋白、抑制剂、抗体及底物的全方位产品组合。义翘神州深耕细胞因子15年,成功开发250个分子、900多种重组细胞因子产品,涵盖干扰素、白介素、生长因子、趋化因子等。除了研究级细胞因子,还开发一系列质量更加稳定可靠的GMP级细胞因子,全力支持JAK-STAT通路研究及药物开发。
| 精选JAK激酶产品列表 | |||
| 货号 | 分子 | 代表性比活性 | 代表性纯度 |
| J01-11G | JAK1 | 10 nmol/min/mg | >90% |
| J01-12BG | JAK1 (R724H) | 28 nmol/min/mg | >90% |
| J02-11G | JAK2 | 98 nmol/min/mg | >90% |
| J03-11G | JAK3 | 113 nmol/min/mg | >90% |
| T21-11G | TYK2 | 1.7 nmol/min/mg | >90% |
| 精选STAT蛋白产品列表 | |||
| 货号 | 分子 | 标签 | 代表性纯度 |
| S52-50G | STAT1 alpha | N-GST | >90% |
| 12766-H20B | STAT1 beta | N-GST & His | >92% |
| S53-54G | STAT2 | N-GST | >80% |
| S54-54G | STAT3 | N-GST | >90% |
| S55-54H | STAT4 | N-His | >95% |
| S56-54H | STAT5A | N-His | >90% |
| S56-54BG | STAT5B | N-GST | >95% |
| S57-30G | STAT6 | N-His | >90% |
| 更多GMP级细胞因子 | |||
| 货号 | 细胞因子 | 内毒素 | 纯度及活性 |
| GMP-11848-HNAE | IL-2 | <0.005 | ≥95%, Active |
| GMP-10395-HNAE | IL-6 | <0.005 | ≥95%, Active |
| GMP-11725-HNAE | IFN-γ | <0.005 | ≥95%, Active |
| GMP-10452-HNAH | OSM | <0.005 | ≥95%, Active |
| GMP-CT011-H08H | IL-12 | <0.005 | ≥95%, Active |
| GMP-10015-HNAH | GM-CSF | <0.005 | ≥95%, Active |
【参考文献】
1. Xin-Yuan Fu. A transcription factor with SH2 and SH3 domains is directly activated by an interferon α-induced cytoplasmic protein tyrosine kinase (s). Cell, 1992. doi: 10.1016/0092-8674(92)90106-m
2. Laura Velazquez et al. A protein tyrosine kinase in the interferon αβ signaling pathway. Cell, 1992.
3. Darnell, J. E., Kerr, I. M. & Stark, G. R. Jak-STAT pathways and transcriptional activation in response to IFNs and other extracellular signaling proteins. Science, 1994. DOI: 10.1126/science.819745
4. Philips RL, at al. The JAK-STAT pathway at 30: Much learned, much more to do. Cell. 2022. doi: 10.1016/j.cell.2022.09.023
5. Hu Q, et al. JAK/STAT pathway: Extracellular signals, diseases, immunity, and therapeutic regimens. Front. Bioeng. Biotechnol. 2023. doi: 10.3389/fbioe.2023.1110765
6. DongLiang, et al. JAK/STAT in leukemia: a clinical update. Molecular Cancer, 2024.
7. Chen Xue, et al. Evolving cognition of the JAK-STAT signaling pathway: autoimmune disorders and cancer. Signal Transduction and Targeted Therapy, 2023.
8. Xiaoyi Hu, et al. The JAK/STAT signaling pathway: from bench to clinic. Signal Transduction and Targeted Therapy, 2021.
9. Anniina Virtanen, et al. JAK inhibitor selectivity: new opportunities, better drugs? nature reviews rheumatology, 2024.