北京义翘神州科技股份有限公司(Sino Biological Inc.)品牌商
17 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
北京义翘神州科技股份有限公司(Sino Biological Inc.)
入驻年限:17 年
- 联系人:
客服部
- 所在地区:
北京
- 业务范围:
技术服务、试剂、抗体、细胞库 / 细胞培养、ELISA 试剂盒
- 经营模式:
生产厂商
推荐产品
公司新闻/正文
CDK激酶抑制剂:为何成为医药巨头的必争赛道?8.5亿美元擦出怎样的火花?
839 人阅读发布时间:2024-11-13 10:52
CDK新进展
2024年10月10日,FDA批准乳腺癌三联疗法,Inavolisib(伊那利塞,新型PIK3CA抑制剂)、Palbociclib(哌柏西利,CDK4/6抑制剂)联合Fulvestrant(氟维司群,雌激素受体调节剂),用于治疗内分泌耐药、PIK3CA突变、HR+、HER2-局部晚期或转移性乳腺癌成人患者。
2024年9月30日,罗氏以8.5亿美元预付款收购锐格医药的下一代CDK抑制剂产品线,打破了百利天恒将EGFR×HER3双抗ADC药物授权给BMS 8亿美元预付款的创新药出海记录。
回溯到2023年11月21日,百济神州以13.3亿美元引进昂胜医药(AI制药公司)的CDK2抑制剂ETX-197,同样剑指乳腺癌。
CDK抑制剂是近年来乳腺癌治疗药物研发的热门靶点。CDK4/6抑制剂颠覆性治疗格局已成为众多药企视为兵家必争之地。
2023年仅辉瑞、诺华、礼来三家CDK4/6抑制剂销售总额就已达到107.96亿美元。随着CDK4/6抑制剂耐药性的出现,其他CDK抑制剂开发也加快步伐,如CDK2、CDK7等,除此之外,CDK9、CDK12、CDK8/19等抑制剂也在肿瘤治疗领域开花。
8.5亿美元补齐乳腺癌“拼图”
罗氏在乳腺癌领域的战略布局非常全面,涵盖PD-L1、HER2、PI3K、CDK等多种靶点,药物类型包括单抗、ADC、双抗、抑制剂等,适应症覆盖乳腺癌早期、晚期、辅助治疗,人群包括HER2阳性、HR阳性、三阴乳腺癌,尤其是积极布局占乳腺癌病例高达65%-70%的HR阳性患者。
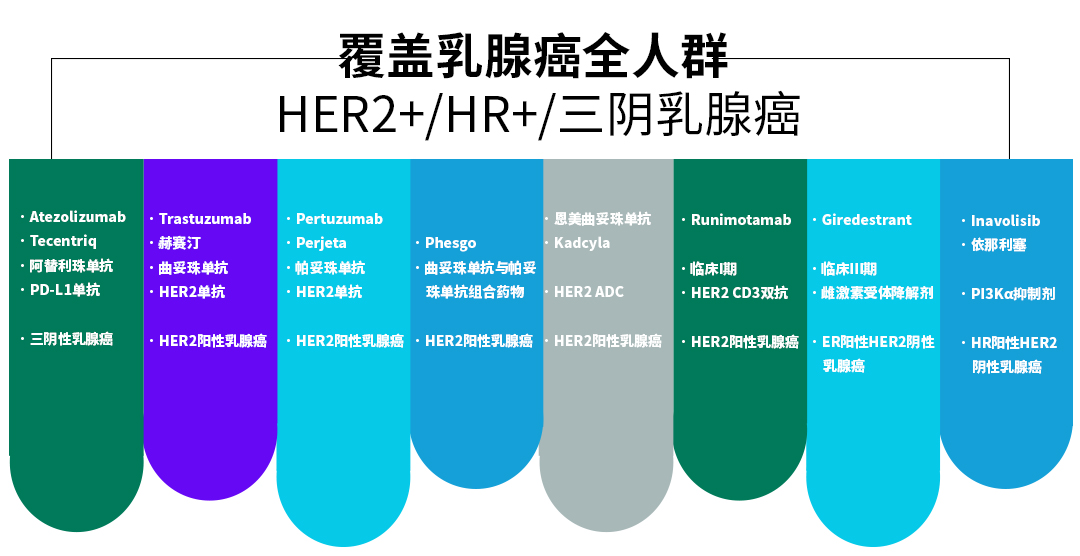
罗氏乳腺癌治疗管线(源自罗氏官网或年报)
罗氏采取层层递进的战略部署,从小分子药物联用CDK4/6抑制剂到补齐下一代CDK抑制剂,使其在乳腺癌治疗领域优势不断扩大。PIK3CA抑制剂Inavolisib三联疗法临床试验的成功,让罗氏认识到CDK抑制剂的重要性,因此用8.5亿美元的前期付款获得相关药物。
锐格医药的CDK抑制剂为何如此值钱?
首先,药物基于独有的差异化AI发现平台(CARD)。如RGT-419B是高效的CDK2和CDK4的双靶点选择性抑制剂,RGT-587是一款可穿越血脑屏障的CDK4选择性抑制剂,可用于治疗大脑转移瘤。
其次,RGT-419B临床试验初期效果可圈可点,在CDK4/6i耐药患者中,所有剂量组的ORR为50%,高剂量组更是实现所有患者肿瘤缩小。与辉瑞的CDK2抑制剂PF-07104091单药(ORR=19%)和CDK2+CDK4抑制剂联用(ORR=28%)相比,效果杠杠的“Best In Class”。在安全性上也优于辉瑞的Atirmociclib(CDK4抑制剂)。
CDK抑制剂:百亿美元赛道
CDK抑制剂市场规模超过百亿美元,是医药巨头必争的大药赛道。如今,罗氏以8.5亿美元的预付款强势收购下一代CDK抑制剂产品,必将加剧乳腺癌市场的竞争。
目前全球已有5款CDK4/6抑制剂获批,包括辉瑞的哌柏西利、诺华/大冢的瑞波西利、礼来的阿贝西利、G1/先声的曲拉西利和恒瑞的达尔西利。2023年,仅辉瑞、诺华、礼来三家的销售总额就达107.96亿美元。据Nature Reviews Drug Discovery预计,到2029年,CDK4/6抑制剂的市场规模将达到200亿美元,占乳腺癌药物销售市场份额的42%。
CDK4/6抑制剂已用于HR+/HER2-乳腺癌全病程,但这还不是CDK抑制剂的终点。CDK4/6抑制剂存在耐药和副作用问题,需要开发新一代抑制剂。在CDK激酶家族中,CDK4和CDK6共同参与细胞周期调控,但功效与毒性分工明确,CDK6与治疗毒性相关性更大。
Atirmociclib是辉瑞首创的CDK4高度选择性抑制剂,其对CDK4的选择性是CDK6的33倍,目前处于临床Ⅲ期。临床Ⅰ期数据显示Atirmociclib组合疗法治疗接受过多种前期治疗的乳腺癌患者的ORR达到32%,而接受已有疗法的ORR小于10%。同时,Atirmociclib具有安全性和耐药性优势。
全球还没有CDK2抑制剂获批上市,辉瑞PF-07104091进度最快,处于临床II期。PF-07104091单药治疗具有良好耐受性,且针对CDK4/6抑制剂耐药后的HR+/HER2-乳腺癌具有良好疗效。如上所示,RGT-419B后来者居上,ORR达到50%,远远高于PF-07104091的19%。
CDK抑制剂为何这么神奇?
CDK是细胞周期蛋白依懒性激酶,与细胞周期蛋白(Cyclins)相结合,在细胞周期调节与转录过程中发挥核心作用。在多种癌症中CDK被过度激活,是癌细胞异常生长的关键因素。开发选择性CDK抑制剂可实现肿瘤精准治疗。
目前已发现的CDK蛋白约有20种,按照其功能不同可以分为两类:一类参与细胞周期调控,主要包括CDK1、CDK2、CDK4、CDK6等,另一类参与转录调节,主要包括CDK7、CDK8、CDK9、CDK10、CDK11等。
正常细胞中,CDK4/6和Cyclin D的活性受到胞外有丝分裂信号的严格调控,但在肿瘤细胞中,蛋白激酶一直处于激活状态,造成细胞分裂不受控制,持续增殖。CDK4/6抑制剂高效精准的抑制癌细胞中的激酶活性,阻断细胞周期从G1期到S期的进程,进而抑制肿瘤细胞增殖。而CDK2在CDK4/6抑制剂耐药性乳腺癌中表现出治疗潜力。
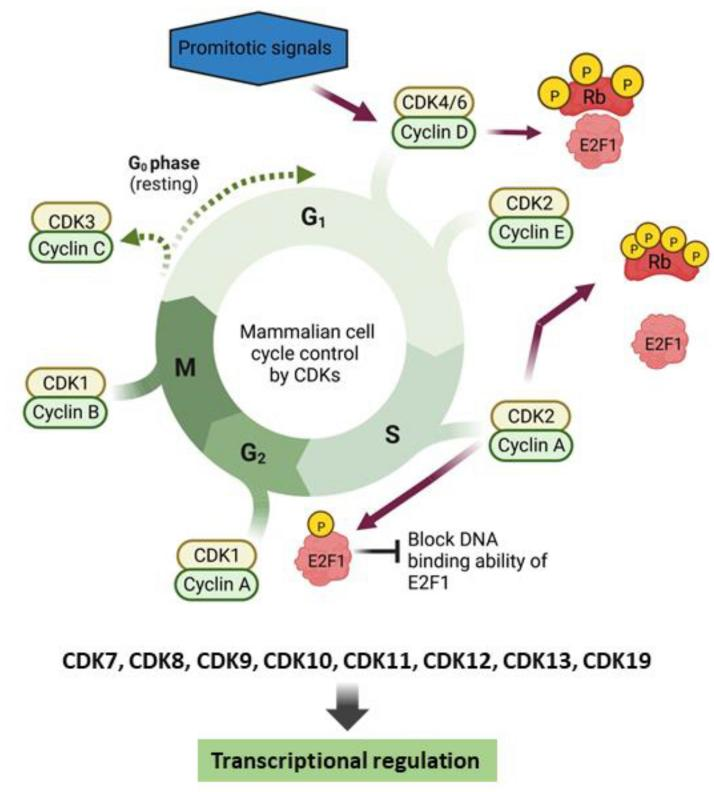
CDK蛋白参与细胞周期调控的分子机制
(源自文献:doi: 10.1016/j.semcancer.2022.12.006)
CDK调控细胞周期的分子机制
按照细胞增殖阶段将细胞周期分为G0期、G1期、S期、G2期和M期。
G0期:大多数成体细胞处于G0期,在有丝分裂原刺激下进入细胞增殖周期。CDK3/Cyclin C使视网膜母细胞瘤蛋白(Rb)磷酸化,细胞进入G1期。
G1期:主要生成大部分细胞生长需要的DNA、RNA和蛋白质。促有丝分裂信号促进Cyclin D合成,并结合CDK4/6,随后激活CDK2/Cyclin E。CDK4/CDK6使视网膜母细胞瘤蛋白(Rb)磷酸化,CDK2进一步使Rb过度磷酸化,进而释放E2F转录因子,使细胞进入S期。
S期:细胞继续合成DNA,并合成组蛋白和DNA复制所需酶。Cyclin A表达增加,一直维持到G2/M期。CDK2与Cyclin E分离,并与Cyclin A结合,促进细胞向G2期转化。
G2期:主要是完成染色体的微管组装。CDK2与Cyclin A分离,CDK1/Cyclin A复合物占主导。
M期:CDK1与Cyclin B结合,促进细胞周期进展。Cyclin B被降解,Rb被蛋白磷酸酶PP1和PP2A去磷酸化,使细胞回到G0期。
CDK在细胞周期调控中的重要功能,使其成为转化潜力巨大的药物靶点。CDK抑制剂从一代到三代无疑是小分子药物开发的缩影。进一步深入研究如何降低毒性、探索预测的生物标志物和确定CDK4/6抑制剂的耐药机制,开发多靶点的抑制剂,将会为CDK抑制剂应用提供更广的范围。
义翘神州CDK相关产品
SignalChem Biotech(义翘神州全资子公司)是全球激酶蛋白重要供应商,专注于研究、开发和生产高质量酶类蛋白产品。SignalChem Biotech已成功开发1100多种具有生物活性的激酶蛋白,覆盖90%以上的人类激酶组,其中包括400多种临床相关的激酶突变体。
义翘神州及SignalChem Biotech可以提供CDK1-CDK20及其细胞周期蛋白复合体相关的重组蛋白和抗体,对于推进更有效、针对性的癌症及其他细胞周期失调疾病的治疗研究至关重要。
| 义翘神州CDKs相关磷酸化抗体 | ||
| 货号 | 抗体 | 应用 |
| 111301-R0019 | Phospho-cdc2 (Tyr15) Antibody, Rabbit MAb | WB |
| 111281-R0043 | Phospho-cdc25C (Ser216) Antibody, Rabbit MAb | WB |
| 110565-R0009 | Phospho-Chk1 (Ser345) Antibody, Rabbit MAb | WB |
| 111279-R0045 | Phospho-Chk1 (Ser317) Antibody, Rabbit MAb | WB, IHC-P |
| 111277-R0032 | Phospho-Chk2 (Thr68) Antibody, Rabbit MAb | WB |
【参考文献】
1. 各公司官网或年报
2. Tobias Otto and Piotr Sicinski, Cell cycle proteins as promising targets in cancer therapy. Nature Reviews Cancer. 2017, oi:10.1038/nrc.2016.138
3. Stephin J. Vervoort, et al. Targeting transcription cycles in cancer. Nature Reviews Cancer. 2021
4. Muhammad Jameel Mughal, Kinjal Bhadresha and Hang Fai Kwok, CDK inhibitors from past to present: a new wave of cancer therapy, Seminars in Cancer Biology, 2022