北京义翘神州科技股份有限公司(Sino Biological Inc.)品牌商
17 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
北京义翘神州科技股份有限公司(Sino Biological Inc.)
入驻年限:17 年
- 联系人:
客服部
- 所在地区:
北京
- 业务范围:
技术服务、试剂、抗体、细胞库 / 细胞培养、ELISA 试剂盒
- 经营模式:
生产厂商
推荐产品
公司新闻/正文
疫苗界的三国演义:RSV疫苗的全球研发大战
925 人阅读发布时间:2024-06-07 18:16
简讯
2024年5月31日,美国FDA批准第三款呼吸道合胞病毒(RSV)疫苗mRESVIA(mRNA-1345)上市,mRESVIA由Moderna开发,是全球RSV mRNA疫苗,用于预防60岁及以上成年人RSV引起的疾病。
2023年被称为“RSV疫苗商业化元年”,GSK的Arexvy、辉瑞的Abrysvo分别在5月和8月获批上市。据两家公司的财报显示,2023年两款疫苗的销售额近25亿美元。
RSV疫苗是诸多市场的“香饽饽”,主要以pre-F为抗原。pre-F蛋白结构不稳定,增大疫苗研发的难度。义翘神州成功开发具有稳定结构的pre-F蛋白,助力RSV疫苗百亿蓝海市场角逐战。
mRESVIA疫苗
mRESVIA是一款编码RSV病毒稳定pre-F蛋白的mRNA疫苗。F蛋白在RSV表面表达,是病毒感染并进入宿主细胞的必需蛋白。F蛋白在RSV-A和RSV-B亚型中高度保守,诱导更高的中和抗体反应,是疫苗设计的重要靶点。mRESVIA使用脂质纳米颗粒(LNP)递送系统,可提高疫苗的稳定性和有效性。
RSV pre-F蛋白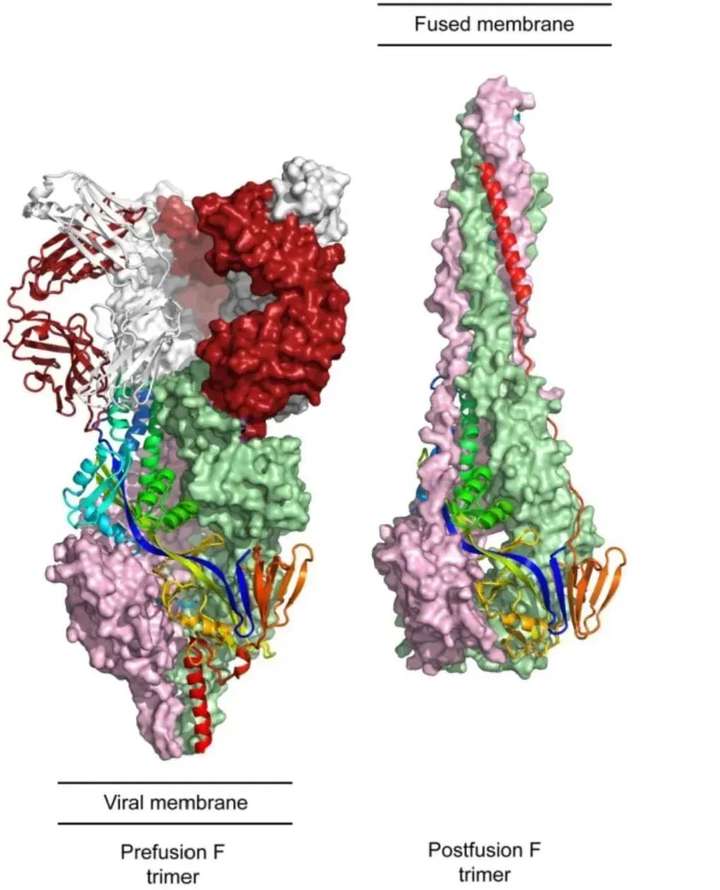
融合前后RSV F蛋白的构象变化(源自参考文献:doi:10.1007/978-3-642-38919-1_4.)
RSV病毒表面的F蛋白通常以三聚体形式存在,与硫酸乙酰肝素结合,促进病毒与宿主细胞的融合。F蛋白在不同毒株中相对保守,且在病毒入侵过程中起到关键作用,是RSV疫苗开发的重要靶点。在病毒与宿主细胞膜融合的过程中,F蛋白构象会发生变化,从融合前pre-F构象转化为融合后post-F构象。
研究发现RSV-F存在6种不同的抗原位点,其中4种抗原位点在融合前后均存在。而Φ和Ⅴ位点是仅存在于pre-F构象中的中和抗体敏感位点,因此pre-F蛋白能诱导更高的中和抗体反应,是疫苗设计的关键。因为pre-F蛋白处于亚稳定状态,容易转变为post-F蛋白,所以,如何构建稳定的pre-F蛋白是疫苗开发的关键。
mRESVIA疫苗用于预防60岁及以上成年人RSV引起的下呼吸道疾病(RSV-LRTD)和急性呼吸疾病(ARD)。获批基于关键的ConquerRSV研究中期结果,该研究是一项随机、双盲、安慰剂对照的临床试验,参与对象包括22个国家、约3.7万名、60岁或以上成年人。中位随访3.7个月,研究结果达到两个主要疗效终点:
- 出现两种或以上症状时,安慰剂组发现55例RSV-LRTD患者,mRESVIA组发现9例,疫苗效力(VE)为83.7%。
- 出现三种或更多症状时,疫苗效力为82.4%。
另一项长期研究显示,中位随访8.6个月内mRESVIA疫苗可长期预防RSV-LRTD。
Ⅲ期试验未发现严重安全问题,常见不良反应包括注射部位疼痛、疲劳、头痛、肌痛和关节痛。
RSV疫苗“三足鼎立”
2023年5月3日,FDA批准GSK的RSV疫苗Arexvy上市,预防60岁及以上人群由RSV引起的下呼吸道疾病(RSV-LRTD),成为第一款获FDA批准的RSV疫苗。Arexvy属于重组单位疫苗,包含重组亚基pre-F糖蛋白抗原 (RSVPreF3) 以及AS01E佐剂。III期临床结果显示,Arexvy的总体疫苗效力为82.6%,对严重RSV-LRTD(至少有2种下呼吸道症状或体征)的效力为94.1%。
Arexvy获批上市后不到一个月,FDA批准第二款RSV疫苗:辉瑞的Abrysvo。两者同为重组亚单位疫苗,且适用人群相同。在III期临床试验中,共有约3.7万名试验参与者,结果显示,与安慰剂相比,辉瑞的Abrysvo在预防至少有两种症状的RSV-LRTD方面的有效率为66.7%,在预防有三种或以上症状感染方面的有效率为85.7%。
Arexvy获批上市后一年,FDA批准第三款RSV疫苗,即以上的mRESVIA疫苗。至此,RSV疫苗形成“三足鼎立”的之势。
在获得批准的第一年,Arexvy为GSK创收12亿英镑(约15.7亿美元),Abrysvo在2023年的销售额达到8.9亿美元。Moderna将2024年全部销售额定位在40亿美元,其中包括mRESVIA疫苗。
RSV“黄金赛道”加速
RSV属于呼吸道病原体,传染性高,且季节性流行。目前尚无RSV感染的具体治疗方法。
RSV易感人群基数大、症状表现较为严重、针对治疗缺乏,造成RSV疫苗市场需求爆发。RSV疫苗被称为人类传染病领域的"最后一片蓝海"。由于RSV病毒表面蛋白结构的特殊性,60多年来RSV疫苗研发频频失败。
直到2023年,RSV疫苗研发终于迎来曙光。两款亚单位重组疫苗的上市,正式开启RSV疫苗“元年”,目前全球有多家企业布局RSV疫苗。
赛诺菲的SP0256是一款RSV-hMPV-PIV三联mRNA疫苗,主要用于老年人。临床试验Ⅰ/Ⅱ期结果显示,mRNA疫苗耐受性良好,显著提高RSV中和抗体应答。目前试验还在进行中,预计在2025年4月结束。
赛诺菲减毒活疫苗RSVt(SP0125)在幼儿中疗效显著,能够诱导广泛而持久的免疫反应。全球Ⅰ/Ⅱ期临床试验结果积极,两剂次RSVt疫苗具有与安慰剂相似的耐受性,并能够诱导93%的抗体反应。目前正在开展全球Ⅲ期临床试验,并在近期获得中国NMPA批准开展临床试验。受试者为6至22月龄以下婴幼儿,不考虑RSV基础血清抗体状态。受试者将按1:1的比例随机接受2剂疫苗或安慰剂,两剂给药间隔56天,鼻内给药,分别评估疫苗对下呼吸道疾病(LRTD)和上呼吸道疾病(URTD)的有效性。
数据主要来自药融云数据库和各公司官网
RSV疫苗:中国必争
研究数据显示在2009年-2019年十年间,我国严重的呼吸道感染患者中,28.5%的患者感染流感病毒,16.8%的患者感染RSV。在肺炎患者中,RSV的感染率更是攀升至22.1%。RSV是可比肩流感,具有同等危害性的流行性病毒。
RSV疫苗蓝海市场空间巨大。预计到2032年,RSV药物整体全球市场(包括治疗药物及预防疫苗)将增至128亿美元,中国RSV药物市场将增至15亿美元,其中疫苗预计占到一半以上。
跨国制药公司看重中国市场。除了赛诺菲RSVt疫苗获得CDE临床研究许可,6月1日辉瑞制药的RSV疫苗获得NMPA临床试验受理。早在2023年GSK就已申报中国临床。
国内RSV疫苗研发正在持续加速,目前已超过10家企业,比如重组亚单位疫苗有艾棣维欣、三叶草生物、康乐卫士等,mRNA疫苗有深信生物、达冕生物、石药集团等。
艾棣维欣在疫苗方面的速度位居国产药企前列。ADV110是一款含有新型佐剂(AE-011)的RSV蛋白亚单位候选疫苗,用于保护6个月至5岁的儿童及65岁以上的老年人。与大不部分靶向F蛋白疫苗不同,ADV110靶向G蛋白。《Vaccines》公布的Ⅰ期临床数据显示,ADV110安全性和耐受性良好,大多数受试者有显著的抗体应答。Ⅱ期临床数据已发表在《medRxiv》,临床研究取得积极进展。
深信生物在6月5日宣布,RSV mRNA疫苗IN006临床申请获得中国国家药品监督管理局药品审评中心(CDE)的默示许可。IN006是基于深信生物自主知识产权的mRNA-LNP技术平台开发的二价RSV预防性疫苗,含有分别编码RSV-A和RSV-B稳定融合pre-F蛋白的mRNA。IN006于2024年1月获得FDA IND批准。本次获批标志着IN006是在国内获批临床的非新冠mRNA预防性疫苗产品。
注:数据主要来自药融云数据库和各公司官网
经验证的稳定RSV-pre-F三聚体蛋白
义翘神州已开发具有稳定融合前构象的Pre-F蛋白(货号:11049-VNAS)、RSV Pre-F小鼠血抗体滴度检测试剂盒(货号:KIT053)、RSV-F (A2) 肽库(货号:PP004)等产品以助力RSV疫苗开发。
高稳定性
RSV Pre-F蛋白 (Cat: 11049-VNAS) 经反复冻融5次或置于4℃放置48 h后,理化性质不改变,稳定性高。
Pre-F蛋白经5次反复冻融后,经过ELISA结合验证,结果显示与抗体结合活性不改变。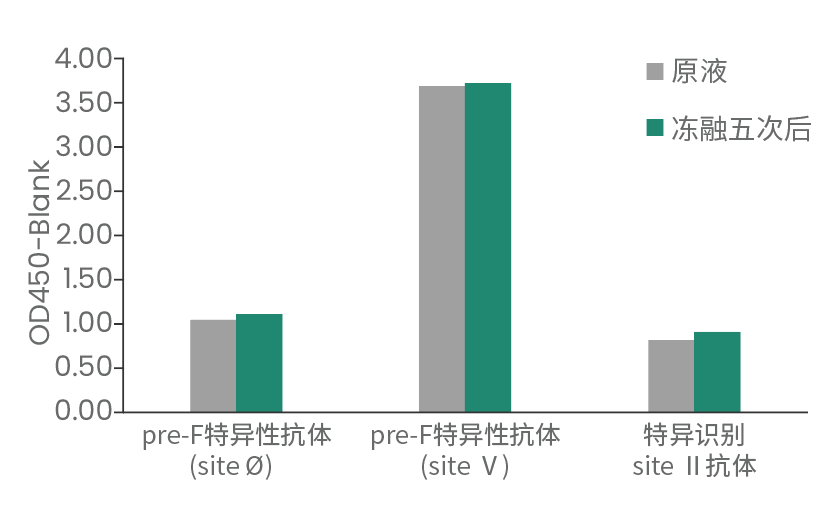
【参考文献】
1,J Tregoning, et al., RSV vaccines: a new hope but the virus might strike back. Vaccine Insights 2024; 3(1), 47-64.
2,You Li, et al. Global, regional, and national disease burden estimates of acute lower respiratory infections due to respiratory syncytial virus in children younger than 5 years in 2019: a systematic analysis. Lancet 2022,
3. 公司官网发布信息(官网或财报)。