北京义翘神州科技股份有限公司(Sino Biological Inc.)品牌商
17 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0
- 0
- 2
- 2
品牌商
北京义翘神州科技股份有限公司(Sino Biological Inc.)
入驻年限:17 年
- 联系人:
客服部
- 所在地区:
北京
- 业务范围:
技术服务、试剂、抗体、细胞库 / 细胞培养、ELISA 试剂盒
- 经营模式:
生产厂商
推荐产品
公司新闻/正文
蛋白A/G/L琼脂糖纯化树脂使用攻略
3431 人阅读发布时间:2017-05-11 10:39
一、基础知识概览
蛋白A/G/L是从不同细菌中分离出来的一系列蛋白,可以特异性的结合抗体(详见附录1),从而被用于抗体纯化。蛋白A/G/L作为亲和配基被偶联到琼脂糖基质上, 蛋白A琼脂糖(Protein A agarose),可以特异性的和样品中的抗体分子结合,而与其他杂蛋白不结合,具有极高的选择性,可用于多种抗体(单抗和多抗)的分离纯化。蛋白A/G/L的种属来源和结合特性存在差异(见表1)。
二、蛋白纯化流程简述

需注意:上柱之前要确保样品溶液有合适的离子强度和pH值,可以用结合/洗杂缓冲液对血清样品或细胞培养液稀释,或者样品用结合/洗杂缓冲液透析。
三、解惑答疑
问题一:Protein A与Protein G,谁与IgG具有更好的结合能力呢?
答:话说,Protein G要更胜一筹。与Protein A相比,Protein G与血清蛋白结合水平更低,纯度更高,配基脱落也相对更低。另外,重组蛋白G由于已经除去了与白蛋白及细胞表面结合位点,减少了交叉反应和非特异性结合。因此,它比Protein A有更大的亲和力(详见附录1)。
问题二:3类蛋白姐妹花,谁的结合范围更广?
答:Protein L结合更宽范围的抗体类型,涉及IgA、IgD、IgE、IgG、IgM等。尽管有很宽的结合范围,Protein L不是一个通用的抗体结合蛋白,L蛋白结合仅限于那些含有κ轻链的抗体。Protein G能结合所有人和鼠的IgG抗体亚型,而Protein A与IgG的结合强度很大程度上依赖于该抗体的种属和亚型(详见附录1)。
问题三:蛋白纯化过程中易出现哪些问题呢?
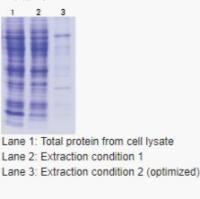
以蛋白A琼脂糖树脂(Protein A Agarose Resin)纯化蛋白为例,小编总结了操作过程中的常见问题及相应解决办法(见表2)。
表2 蛋白A琼脂糖树脂纯化蛋白操作常见问题
问题四:琼脂糖树脂蛋白纯化方法有哪些优点?
答:
a. 可重复循环使用。例如,北京义翘神州科技有限公司(Sino Biological Inc.)的Protein L Agarose Beads / Resin,重复循环使用20次后仍无明显性能变化;
b. 可进行原位清洗(Clean In Place, CIP);
c. 结合和恢复能力稳定性较好。如,义翘神州公司(Sino Biological Inc.)的Protein G Agarose Beads / Resin,在使用7天后,恢复能力依然比较稳定。
附录1 蛋白A、G及L对不同物种Ig的结合能力总览

蛋白A/G/L是从不同细菌中分离出来的一系列蛋白,可以特异性的结合抗体(详见附录1),从而被用于抗体纯化。蛋白A/G/L作为亲和配基被偶联到琼脂糖基质上, 蛋白A琼脂糖(Protein A agarose),可以特异性的和样品中的抗体分子结合,而与其他杂蛋白不结合,具有极高的选择性,可用于多种抗体(单抗和多抗)的分离纯化。蛋白A/G/L的种属来源和结合特性存在差异(见表1)。
表1 蛋白A/G/L的种属来源和结合特性上的差异
| Protein A | Protein G | Protein L | |
| 分离自/菌属 | 金黄色葡萄球菌 | C型或G型链球菌属 | 马格努斯消化链球菌 |
| 结合区域 | Ig Fc区域 | Ig Fc区域 | 通过轻链结合抗体 |
二、蛋白纯化流程简述

需注意:上柱之前要确保样品溶液有合适的离子强度和pH值,可以用结合/洗杂缓冲液对血清样品或细胞培养液稀释,或者样品用结合/洗杂缓冲液透析。
三、解惑答疑
问题一:Protein A与Protein G,谁与IgG具有更好的结合能力呢?
答:话说,Protein G要更胜一筹。与Protein A相比,Protein G与血清蛋白结合水平更低,纯度更高,配基脱落也相对更低。另外,重组蛋白G由于已经除去了与白蛋白及细胞表面结合位点,减少了交叉反应和非特异性结合。因此,它比Protein A有更大的亲和力(详见附录1)。
问题二:3类蛋白姐妹花,谁的结合范围更广?
答:Protein L结合更宽范围的抗体类型,涉及IgA、IgD、IgE、IgG、IgM等。尽管有很宽的结合范围,Protein L不是一个通用的抗体结合蛋白,L蛋白结合仅限于那些含有κ轻链的抗体。Protein G能结合所有人和鼠的IgG抗体亚型,而Protein A与IgG的结合强度很大程度上依赖于该抗体的种属和亚型(详见附录1)。
问题三:蛋白纯化过程中易出现哪些问题呢?
以蛋白A琼脂糖树脂(Protein A Agarose Resin)纯化蛋白为例,小编总结了操作过程中的常见问题及相应解决办法(见表2)。
表2 蛋白A琼脂糖树脂纯化蛋白操作常见问题
| 问题 | 可能原因 | 建议解决办法 |
| 柱子流速较低(<0.5 mL/min) | 缓冲液中存在气泡或样品中的颗粒堵塞柱子或胶孔 | 缓冲液脱气、过滤样品。注意避免柱子干燥 |
| 洗脱组分中没有目的蛋白 | 抗体被降解 | 使用其抗原做配体的介质 |
| 样品中抗体浓度太低 | 适当提高洗脱pH | |
| 样品与Protein A结合能力低 | 换用其它类型的琼脂糖树脂 | |
| 回收率逐渐减低 | 上样量太多 | 适当减少上样量 |
| 柱子太脏 | 清洗树脂 |
问题四:琼脂糖树脂蛋白纯化方法有哪些优点?
答:
a. 可重复循环使用。例如,北京义翘神州科技有限公司(Sino Biological Inc.)的Protein L Agarose Beads / Resin,重复循环使用20次后仍无明显性能变化;
b. 可进行原位清洗(Clean In Place, CIP);
c. 结合和恢复能力稳定性较好。如,义翘神州公司(Sino Biological Inc.)的Protein G Agarose Beads / Resin,在使用7天后,恢复能力依然比较稳定。
附录1 蛋白A、G及L对不同物种Ig的结合能力总览